Par Karim Benzerara,
La biominéralogie vise à étudier les processus utilisés par le vivant pour précipiter des structures inorganiques. Il s’agit d’un vaste champ de recherche associant chimistes, physiciens, biologistes et géologues. Elle s’est surtout intéressée jusqu’ici aux eucaryotes et aux organismes dits « supérieurs » comme en témoignent les ouvrages de référence portant sur le sujet (Baeuerlein, 2000 ; Mann, 2001 ; Dove et al., 2003). Cela tient vraisemblablement en partie à des raisons méthodologiques : il est plus facile d’analyser des échantillons centimétriques ou millimétriques comme des coquillages ou des squelettes de Vertébrés que des objets micrométriques ; à des raisons pragmatiques : la chimie des squelettes des coraux ou des tests de foraminifères, par exemple, est abondamment utilisée comme outil dans les reconstructions paléoclimatiques (e.g. température, salinité), et il est important de comprendre la nature du message géochimique piégé par ces structures au cours de la biominéralisation. De la même façon, la compréhension des pathologies du squelette humain a encouragé l’étude des mécanismes de sa formation ; enfin, des raisons « philosophiques » : il est encore souvent suggéré que seuls les organismes dits « supérieurs » ont développé une stratégie de biominéralisation dans différents « buts », alors qu’il ne s’agirait pas d’une stratégie évolutive chez les procaryotes la rendant ainsi beaucoup moins intéressante. Nous examinerons cependant principalement les mécanismes de biominéralisation existant chez les procaryotes afin de comprendre s’il peut exister des signatures de la vie dans les produits résultants et de mieux en connaître la nature. Nous verrons comment de telles signatures sont au cœur des débats sur les scénarios de l’apparition de la Vie sur Terre et dans le système Solaire.
.
I. Vie sur Mars et premières traces de vie sur Terre : de la difficulté de reconnaître les traces de la Vie
A. Les traces de vie dans la météorite martienne ALH84001
La météorite ALH84001 a été ramassée en Antarctique en 1984. L’étude de sa minéralogie et de sa chimie a permis de reconstituer plusieurs points clé de son histoire (Barber and Scott, 2003). C’est une roche magmatique formée il y a près de 4.5 milliards d’années et constituée principalement d’orthopyroxène, un silicate de fer et de magnésium (formule). Elle se rattache au groupe des SNC (Shergotty-Nakhla-Chassigny du nom des météorites références de cette famille) par sa composition isotopique particulière en oxygène, et provient donc vraisemblablement de Mars. Elle a subit une altération à 3.9 Ga (Borg et al., 1999) donnant naissance à des carbonates de calcium, de fer et de magnésium dont la température de formation reste controversée, mais vraisemblablement de basse température (Niles et al., 2005). Plusieurs épisodes thermiques liés à des chocs météoritiques sur la surface de Mars ont pu altérer par la suite sa minéralogie de manière plus ou moins importante. Elle a enfin été expulsée de la surface de Mars par un choc météoritique il y a 16 Ma, et est arrivée sur Terre il y a 13 000 ans. Tombant à la surface des glaces de l’Antarctique, elle a été entraînée en profondeur par les mouvements de glace puis ramenée en surface au pied de la chaîne des Allan Hills ou elle a été récoltée en 1984. McKay et al. (1996) ont affirmé avoir découvert des traces de vie fossile et martienne dans la météorite ALH84001. Ils se sont appuyés pour cela sur trois groupes d’observations offrant d’après eux des critères de biogénicité :
1-la présence de magnétites (Fe3O4) dont 25% présentent des caractéristiques particulières identiques à celles des magnétites formées par une souche bactérienne magnétotactique particulière (MV-1), et qui n’ont jamais été observées dans des magnétites synthétisées par voie abiotique (e.g. Thomas Keprta et al., 2001, 2002).
2- L’observation de formes allongées à bouts arrondis associées aux carbonates d’ALH 84001 et interprétées comme des fossiles microbiens. Ces « fossiles » ayant une taille inférieure a tout procaryote viable connu, ils ont ajouté qu’il s’agissait de nanobactéries dont l’existence sur Terre a été proposée dans différents environnements sédimentaires (Folk, 1996) et dans certaines calcifications pathologiques (Kajander et al., 1998).
3- La présence de mélange d’hydrocarbures aromatiques polycycliques (PAHs) présentant une gamme de poids moléculaires restreinte et dont la répartition est corrélée à celle des carbonates et peut être à celle des nanofossiles par conséquent.
Deux clans se sont ainsi formés : d’une part, les partisans proposant une refonte complète de notre vision de l’apparition de la Vie sur Terre et dans le Système solaire, éventuellement remettant au goût du jour la théorie de la Panspermie (e.g. Sukumaran, 2005) ; d’autre part, les opposants convaincus que les « preuves » fournies étaient trompeuses et stimulant ainsi un grand nombre de travaux visant à réévaluer les critères de biogénicité et à développer les techniques analytiques permettant de mieux caractériser de tels échantillons.
Chacune de ces observations ou bien leur signification en termes de biosignature ont été remises en question. Ainsi, les PAHs peuvent être formés par différents processus abiotiques, et surtout, d’après Stephan et al. (2003), après un réexamen des échantillons à l’aide de techniques analytiques plus résolues, il n’existerait pas de corrélation spatiale entre PAHS et carbonates. En revanche, les PAHS pourraient être spatialement corrélés avec du plomb terrestre, rejoignant les études de Jull et al. (1998) qui avaient montré qu’une grosse partie du carbone organique présent dans ALH84001 était une contamination terrestre.
Golden et al. (2004) ont montré que la décomposition thermique de carbonates de fer, par exemple liée à un métamorphisme de choc peut donner des magnétites semblables à celles observées dans ALH84001.
Enfin, l’interprétation d’observations uniquement morphologiques concluant à la présence de fossiles nanobactériens n’est pas valide. Benzerara et al. (2003) notamment ont montré que de « simples » nanocristaux de calcite pouvaient avoir des morphologies identiques à celles des pseudo-nannobactéries fossiles d’ALH84001. Tout reste à montrer pour les partisans d’une apparition précoce de la Vie sur Mars et les travaux effectués à ce jour sur la météorite ALH84001 ne peuvent en tout cas pas être considérés comme une base solide pour conclure à la présence de traces de Vie martiennes.
.
Figure 1 : Caractérisation des « nanobactéries » de Tatahouine (Benzerara et al. 2003). (a) Image MEB. Les objets présentent une distribution en taille réduite et une morphologie particulière et ont été interprétés initialement comme des nanobactéries. (b) et (c) Observation en MET des mêmes objets montrant que chaque bâtonnet est en fait un monocristal de calcite (diffraction électronique et analyse chimique) entouré d’une couche amorphe de carbonate de calcium (imagerie haute résolution -(c)).
.
B. Les fossiles microbiens les plus anciens sur Terre
Schopf et Packer (1987) ont décrit des objets filamenteux et carbonés interprétés comme des cyanobactéries dans des cherts (dépôts siliceux) d’Australie datés à 3.465 Ga, ce qui en faisait les plus vieux microorganismes connus à la surface de la Terre. Cette découverte était passée dans la culture générale et populaire (voir par exemple le livre Guiness des records), lorsqu’elle fut complètement remise en question par Brasier et al. en 2002. Ce débat scientifique dégénéra très vite en une affaire assez glauque à mon goût, avec notamment une accusation de fraude de la part de l’ancienne étudiant de Schopf (e.g.Dalton, 2002). L’environnement sédimentaire de Schopf a été réinterprété de manière convaincante en un environnement hydrothermal par Brasier. Celui ci a montré de plus que les filaments de Schopf étaient plutôt des juxtapositions de grains de carbone en voie de graphitisation et que Schopf n’avait sélectionné que certains filaments ressemblant à des microorganismes mais que de nombreux autres pourtant présents dans les roches avaient des morphologies très différentes et peu ressemblantes à des morphologies cyanobactériennes. Enfin, Brasier rappela que des processus biotiques (par exemple des réactions de Fisher-Tropsch) peuvent conduire à la formation de molécules carbonées. L’ « Early Eden Hypothesis » comme la nomme Brasier devenait ainsi une hypothèse spéculative comme une autre, sans fondement paléontologique en tout cas.
Les biosignatures ne sont pas une idée abstraite dans le sens où des critères testables sont proposés. Un certain nombre d’entre elles ont été utilisées pour étayer certains scénarios de l’apparition de la Vie sur Terre et dans le Système solaire, mais ont pu ensuite s’avérer comme non discriminantes entre processus biotiques et abiotiques. Il est intéressant de constater que les biosignatures proposées dépendent des outils analytiques dont nous disposons et sont par conséquent soumis aux aléas des innovations technologiques. Cependant, une meilleure connaissance des mécanismes de fossilisation ou de biominéralisation serait indispensable afin de comprendre si les critères proposés résultent uniquement de processus biologiques ou bien s’ils peuvent être le produit de réactions abiotiques. C’est un des objectifs du champ d’étude qu’est la biominéralogie qui s’intéresse, en plus des signatures de la vie, à comprendre les stratégies biologiques développées pour la synthèse de matériaux inorganiques.
.
II. Mécanismes de formation des biomagnétites et biosignatures
Il existe une grande diversité de microorganismes pouvant produire des magnétites, soit extracellulaires (par exemple, Shewanella putrefaciens par réduction du Fer III en Fer II), soit intracellulaires. Dans ce dernier cas, certains microorganismes peuvent ainsi s’aligner passivement selon les lignes du champ magnétique terrestre et se déplacer activement selon une dimension, on parle de microorganismes magnétotactiques. Certains microorganismes magnétotactiques, notamment des bactéries marines synthétisent des nanocristaux de greigite (Fe3S4) qui présentent des propriétés magnétiques analogues à celles des magnétites. Les bactéries magnétotactiques sont l’exemple type et quasi-unique à ce jour de ce qui est appelé la biominéralisation contrôlée biologiquement ou « organic matrix-mediated » (Lowenstam, 1981) ou encore active. Il faut entendre par là que le microorganisme utilise des activités cellulaires spécifiques pour diriger la nucléation, la croissance, la morphologie et la disposition spatiale du cristal produit.
.
A. Rappel sur la structure et les propriétés magnétiques des magnétites
Les magnétites ont une structure cubique. Elles renferment du fer sous deux valences, 2+ et 3+, et présentent des propriétés magnétiques (ferrimagnétiques) lorsqu’elles ont un facteur de forme et une taille donnée (cf. diagramme de Butler-Banerjee). La plupart des magnétites bactériennes ont une taille comprise entre 35-120 nm ce qui leur confère des propriétés ferrimagnétiques (elles sont alors qualifiées de monodomaines). Il existe une connaissance assez importante des propriétés des magnétites synthétisées par voies abiotiques du fait des applications industrielles notamment pour les enregistrements magnétiques audio et vidéo.
.
B. Etude des mécanismes de formation biologique des magnétites
Il n’existe à ce jour pas de bactérie cultivable synthétisant de la greigite. La plupart des idées existantes sur les mécanismes de biominéralisation des phases magnétiques sont donc fondées sur quelques souches produisant des magnétites.
.
1. Magnétites intracellulaires
Les bactéries magnétotactiques sont des bactéries motiles qui ont été retrouvées dans un grand nombre d’environnements aquatiques (eau douce, salée, saumâtre). Elles sont en général microaérophiles et vivent dans la zone de transition entre milieu oxique et anoxique. Ces microorganismes peuvent utiliser les nitrates comme accepteurs d’électrons. Les premières ont été décrites par Blakemore en 1975. Elles synthétisent des nanocristaux de magnétite à l’intérieur de vésicules intracellulaires appelées magnétosomes qui servent d’aimant permettant aux cellules de s’orienter selon les lignes de champ magnétique (e.g. Baeuerlein, 2000). Il a ainsi été proposé que ce tactisme présente un avantage évolutif pour ces microorganismes leur permettant de trouver plus facilement les zones présentant les conditions de fugacité en oxygène les plus adaptées à leur développement. Il reste cependant un travail important à réaliser sur l’écologie et l’évolution de cette stratégie.
.
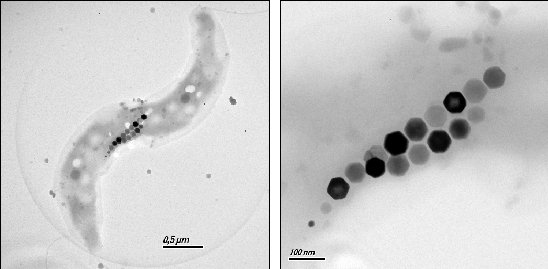
Figure 2 : Image en MET de chaînes de magnétites dans un vibrio. On remarque les magnétites de plus petite taille à une des extrémités de la chaîne par laquelle elle s’accroît. (de N. Menguy et A. Isambert)
.
Plusieurs études de génétique, et de biochimie ont commencé à préciser les mécanismes moléculaires impliqués dans la formation des magnétosomes (Schüler, 2004). Les vésicules sont formées avant la précipitation de magnétite. Elles sont délimitées par une membrane de 3-4 nm d’épaisseur contenant des protéines intramembranaires semblables à celles de la membrane cytoplasmique et d’autres spécifiques des magnétosomes. De nombreuses protéines des magnétosomes ont été identifiées par la construction de banque de mutants mais la fonction de beaucoup d‘entre elles reste inconnue. Le fer est transporté de l’extérieur de la cellule vers l’intérieur selon un mécanisme restant à préciser, peut être via des sidérophores qui sont des molécules de faible poids moléculaire présentant une affinité très élevée pour les métaux divalents. Puis le fer est vraisemblablement réduit en Fer 2+ et transporté sous cette forme dans le magnétosome par l’intermédiaire de transporteurs. Le fer est ensuite oxydé partiellement et précipite pour donner des magnétites. La taille des magnétites pourrait être contrôlée par les vésicules mais le mécanisme reste flou. En considérant la morphologie des biomagnétites, il faut a priori inhiber spécifiquement la croissance de certaines faces qui deviennent alors très développées alors que d’autres faces sur lesquelles ne se fixent pas d’inhibiteurs ont par conséquent une surface réduite. Si les inhibiteurs sont placés dans la membrane des vésicules de manière asymétrique, on peut imaginer la possibilité d’une croissance des magnétites allongée dans une direction. Les génomes de deux souches magnétotactiques (Magnetococcus MC-1 et Magnetospirillum magnetotacticum) sont actuellement en cours de séquençage et permettront vraisemblablement d’autres avancées sur la compréhension des mécanismes impliqués. Une question posée a été celle de l’ancienneté du magnétotactisme. Les analyses phylogénétiques (séquençage de l’ADN ribosomal 16S) ont montré que le magnétotactisme était présent chez différents groupes bactériens à savoir les alpha-Proteobacteria, les delta-Proteobacteria, et les Nitrospira (e.g. Flies et al., 2005). Il est possible que d’autres groupes et que certaines Archae notamment soit magnétotactiques, mais cela n’a pas été recherché intensément jusqu’ici. On ne sait pas de plus si ces différents groupes utilisent un appareillage biochimique homologue ou si le magnétotactisme est apparu plusieurs fois indépendamment (Delong et al., 1993). La possibilité de transferts horizontaux de gènes a aussi été évoquée. Certains auteurs proposent que le magnétotactisme est très ancien ( 2 Ga) sur la base d’observations dans des sédiments très anciens de magnétites qu’ils pensent être biogéniques (Chang et al., 1989). Ceci s’appuie sur l’existence postulée de biosignatures du type de celles proposées pour la météorite martienne ALH84001 et que nous allons détailler.
.
2. Magnétites extracellulaires
Certains microorganismes (Geobacter sp. et Shewanella sp.) sont capables de former des magnétites en milieu extracellulaire. Ces microorganismes anaérobies utilisent le carbone organique comme donneur d’électrons et le fer comme accepteur. Le fer II ainsi produit réagit avec le fer III présent dans le milieu pour former des magnétites de valence mixte. Il s’agit cette fois-ci d’un mécanisme plus indirect qualifié de biominéralisation « induite » ou « passive ». Il est intéressant de comparer les différentes caractéristiques de telles magnétites avec celles des magnétites intracellulaires.
.
C. Détermination empirique de biosignatures et leur validité
Le problème conceptuel posé par les biosignatures en général est que l’on n’a pas forcément exploré tout le champ des possibles en conditions abiotiques. Pour les magnétites cependant, les nombreux travaux réalisés à diverses fins industrielles ont fait penser que le champ des possibles était connu. Plusieurs caractéristiques particulières ont été relevées pour les magnétites formées par une souche en particulier, Magnetovibrio MV-1 : une grande pureté chimique (Fe3O4), même en présence de métaux pouvant entrer dans la structure de la magnétite (Ti, Cu etc…) dans le milieu de culture. La quasi totale absence de défauts cristallins. Une distribution en taille très réduite pour les populations de magnétites avec une taille moyenne correspondant à des monodomaines et donc des propriétés magnétiques « optimales ». Eventuellement, l’arrangement en chaînes des magnétites qui néanmoins est fortement susceptible de disparaître après la mort du microorganisme lors de la diagenèse des sédiments. Enfin des morphologies particulières et notamment un allongement selon une direction cristallographique précise et le développement différentiel et spécifiques de certaines faces cristallographiques (e.g. Devouard et al., 1998).
.
Figure 3 : Interprétation de la morphologie et indexation cristallographique à partir d’une projection 2D d’une biomagnétite en MET. On a ici une forme nommée cubo-ocatèdre, une des formes que peuvent prendre les magnétites abiotiques et biologiques (photos N. Menguy).
.
Il est à noter que toutes les magnétites de MV-1 ne remplissent pas ces critères et que différentes espèces synthétisent des magnétites avec des morphologies différentes notamment. D’autres auteurs ont proposé des critères fondés sur des mesures de magnétisme des échantillons afin de rendre la recherche de telles signatures dans des échantillons dilués plus facile (Weiss et al., 2004). Il a cependant été constaté que certains de ces critères peuvent être satisfaits aussi par des magnétites formées extracellulairement par Geobacter (Vali et al., 2004).
Le champ des possibles n’avait cependant pas complètement été exploré, notamment dans le cadre de la recherche de biosignatures sur ALH84001. Ainsi, Golden et al. (2004) ont montré que la décomposition thermique de sidérite (FeCO3) au dessus de 450 °C pouvait induire la formation de magnétites pures chimiquement, présentant des morphologies particulières allongées selon la direction cristallographique (111) des magnétites. Ils ont par ailleurs montré que dans ALH84001, les magnétites étaient associées à des cristaux de périclase (MgO) ce qui est compatible avec un scénario de décomposition thermique d’un carbonate de fer et de magnésium, et que les magnétites présentaient une orientation cristallographique préférentielle et parallèle à celle du carbonate hôte suggérant que la magnétite provenait d’une transformation à l’état solide du carbonate. Plus que la remise en cause des biosignatures observées sur certaines souches magnétotactiques dont la morphologie reste assez unique, Golden conteste profondément la caractérisation des magnétites d’ALH84001 faite par Thomas Kerpta, illustrant ainsi le fait que certaines peuvent être relativement subjectives ou alors dépendante de la qualité des outils analytiques à disposition.
Il est indispensable de mieux connaître les mécanismes de biominéralisation, afin notamment de ne plus avoir une approche uniquement empirique pour la détermination des biosignatures qui sont dans ce cas souvent condamnées à être infirmées.
.
III. Mécanismes de formation des phosphates et carbonates de calcium et biosignatures
Ce type de biominéralisation n’a reçu qu’une attention dérisoire en biominéralogie certainement parce qu’elle est souvent considérée a priori comme n’ayant aucun intérêt évolutif. Les précipitations de phosphates et de carbonates de calcium par des microorganismes sont ainsi souvent décrites comme des exemples de biominéralisation « induite biologiquement » (Lowenstam, 1981) ou encore biominéralisation « passive ». Cette terminologie désigne les processus biominéralisateurs déclenchés indirectement par les microorganismes (variation de pH etc…), et dans lesquels il n’y a pas de contrôle du microorganisme sur le produit et donc pas de distinction possible des produits avec ceux qui seraient mis en place par des processus purement abiotiques.
.
A. Les phosphates bactériens : où médecine et sciences de la Terre se rejoignent
Nous verrons comment les phosphates de calcium précipités en présence de microorganisme constituent une parfaite illustration du débat existant sur la possibilité de conserver des signatures au sein de minéraux issus d’une biominéralisation induite.
.
1-Existe t-il des biosignatures dans les phosphates bactériens ?
Il s’agit d’un débat relativement ancien. Chez les Vertébrés, la formation du squelette par précipitation d’hydroxyapatite fait intervenir une succession complexe d’étapes avec différents régulateurs et est considéré comme un exemple de biominéralisation contrôlée (e.g . Dove et al., 2003). Bien que les produits soient très similaires, on considère souvent qu’il s’agit en revanche d’une biominéralisation induite chez les microorganismes. Pourtant de nombreuses observations en sciences de la Terre d’échantillons naturels, notamment de phosphorites (O’Brien et al. 1981), suggéraient que les phosphates de calcium pouvaient fossiliser les formes microbiennes et renfermaient donc des signatures morphologiques. A contrario, Blake et al. (2001), par exemple, affirmait sur la base d’expériences en culture que les phosphates de calcium ne précipitaient pas spécifiquement sur des cellules bactériennes et avaient des caractéristiques morphologiques et minéralogiques identiques à des phosphates de calcium purement abiotiques. Un débat similaire eut lieu à propos de microorganismes de très petite taille, appelés nannobactéries qui d’après Kajander et al. (1998) seraient impliqués dans des processus pathogéniques de précipitation d’hydroxyapatite. Vali et al. (2001) s’appuyant sur des observations similaires des mêmes objets conclue qu’il s’agit de précipitations sur des protéines et non pas des microorganismes. C’est l’illustration de la difficulté à caractériser des objets de si petite taille et cela montre l’importance de dégager des biosignatures qui nous aideraient en sciences de la Terre et en médecine à mieux comprendre le rôle des microorganismes dans les phénomènes étudiés.
.
2-Les bactéries montrent une biominéralisation pas si indirecte
Contrairement aux conclusions des études de Blake et al. (2001) et autres, Benzerara et al. (2004) ont montré que la précipitation de phosphate de calcium chez une espèce modèle Gram – conduisait à des structures cristallographiques complexes. La précipitation a lieu préférentiellement sur les cellules bactériennes, et plus précisément au sein du périplasme, c’est-à-dire le volume délimité par les deux membranes formant la paroi. Enfin les cristaux d’hydroxyapatite sont tous orientés les uns par rapport aux autres et parallèlement aux membranes cellulaires. Le résultat peut donc directement être comparé au premier exemple de biominéralisation contrôlé donné par Lowenstam (1981) montrant des cristaux de calcite orientés dans une matrice organique sécrétée par la moule Mytillus californianus et formant in fine sa coquille. En sciences médicales à nouveau, il est connu depuis de longues années que certains pathogènes sont impliqués dans des processus de calcification (caries dentaires, gouttes urinaires). Il avait déjà été proposé une nucléation préférentielle de l’hydroxyapatite au niveau de certaines protéines membranaires de ces espèces (Van Dijk et al., 1998). De nombreux travaux restent à réaliser afin notamment de comprendre si cette capacité à précipiter des cristaux d’hydroxyapatite est plus prononcée chez certaines espèces comme le suggère la littérature médicale, si elle implique la mort des microorganismes ou bien leu confère une protection accrue vis-à-vis de l’action de diverses agressions extérieures notamment les antibotiques, et quels sont exactement les mécanismes moléculaires et minéralogiques impliqués.
.
3- Un intérêt évolutif ?
Ce petit point nous permettra de pointer le doigt sur une des grandes lacunes de la biominéralogie à savoir la compréhension des éventuels enjeux évolutifs impliqués dans les processus de biominéralisation microbienne. Il est ainsi intéressant de remarquer que la précipitation de phosphates de calcium par les microorganismes a toujours été considérée comme un processus dénué de tout avantage évolutif alors que des précipitations similaires sont des stratégies évolutives chez les eucaryotes. Il est encore plus intéressant de constater que lorsque l’on ajoute du plomb ou divers métaux lourds polluants dans le milieu de culture de certains procaryotes, ceux-ci précipitent des phosphates de plomb et autres selon des modalités rappelant fortement celles existant lors de la précipitation d’hydroxyapatite. Or dans le cas des métaux lourds, il est systématiquement conclu qu’il s’agit d’un processus actif de détoxification. En considérant les similitudes entre bioprécipitation des phosphates de calcium et des phosphates de métaux lourds, il sera important à l’avenir de comprendre si dans chacun de ces cas, il n’y a aucun avantage sélectif, ou bien s’il s’agit par exemple de processus actifs de détoxification.
.
B. Les stromatolites comme premières traces de vie : réalité ou mythe ?
Les stromatolites sont des constructions microbiennes laminées pluri-centimétriques, le plus souvent constituées de carbonates de calcium (e.g. Riding & Awramik, 2000). Il existe des stromatolites actuels (par exemple ceux de Shark Bay en Australie), et sur la base d’analogies structurales le plus souvent, il a été proposé que de nombreuses structures laminées de l’Archéen étaient aussi des stromatolites. Bien que ces objets soient retiennent l’attention depuis plus de 100 ans, il est étonnant de constater que les mécanismes de formation sont assez peu compris (Reid et al. 2000). De nombreuses études se sont focalisées sur le rôle des cyanobactéries qui sont souvent observées dans les stromatolites. Il a ainsi été proposé que du fait de leur activité photosynthétique et e la consommation de CO2, les cyanobactéries favorisent la précipitation de carbonates de calcium. Il faut aussi noter que les cyanobactéries qui présentent des morphologies particulières, soit en filaments, et/ou de grande taille généralement, sont plus facilement reconnaissables en microscopie optique et ont ainsi vraisemblablement plus attiré l’attention. Pourtant, on observe des stromatolites dans des milieux très alcalins, très sursaturés par rapport aux carbonates de calcium. Dans de tels milieux, il est vraisemblable que ce simple effet chimique évoqué ci-dessus n’a que peu d’influence (Kempe et al., 1991). De plus, il a été montré qu’il existait une grande diversité de microorganismes hétérotrophes pour le carbone qui coexistaient avec les cyanobactéries dans les stromatolites (Lopez-Garcia et al., 2005). Ainsi certains auteurs ont proposé que ces hétérotrophes favorisent la précipitation des carbonates en dégradant les polysaccharides produits par les cyanobactéries qui seraient des inhibiteurs de la nucléation. Mais d’autres auteurs ont au contraire proposé que les polysaccharides, omniprésents dans les stromatolites étaient pouvaient au contraire favoriser la précipitation de carbonates de calcium en servant de sites de nucléation. Ceci illustre notre pauvre connaissance de la structure tridimensionnelle de ces polysaccharides dans les conditions naturelles et de l’insuffisance des caractérisations faites. Récemment enfin, il a été proposé que des bactéries sulfato-réductrices, responsables d’une augmentation importante de l’alcalinité, pourraient jouer un rôle non négligeable dans la formation des stromatolites. Si l’importance des microorganismes dans la formation des stromatolites actuels, bien que mal comprise, est avérée, le nombre et la pertinence des biosignatures proposées restent assez pauvres. Grotzinger and Rothman (1996) ont récemment remis en cause l’origine biotique de la plupart des stromatolites de l’Archéen en montrant qu’un certain nombre de processus abiotiques pouvaient conduire à des laminations comme celles observées et prises souvent comme un critère en soi. Là encore, cette exemple illustre l’importance qu’auront des outils analytiques permettant une caractérisation de plus en plus poussée et exacte des échantillons géomicrobiologiques pour une compréhension plus affinée de leur origine.
.
Conclusion
Nous avons vu que microorganismes interviennent de manière importante dans la formation de minéraux. Il a été proposé que ces minéraux diffèrent de minéraux précipités abiotiquement conduisant à la notion de biosignatures. Pourtant afin de mieux comprendre leur validité et de tester si elles ne peuvent vraiment pas être synthétisées par des conditions abiotiques rencontrées dans la nature, il faudra améliorer notre connaissance des mécanismes impliqués. La biominéralogie des procaryotes ne doit plus être séparée de celle des eucaryotes. Elle implique, en effet, vraisemblablement des mécanismes aussi complexes que ceux existant chez les eucaryotes et pourra d’ailleurs permettre une meilleure compréhension des processus chez ces derniers notamment parce que la génétique et la génomique sont plus aisées à réaliser chez les procaryotes. La biominéralogie appelle un travail pluridisciplinaire. Les chimistes ont déjà largement progressé vers la compréhension des liens entre conditions chimiques-mécanismes réactionnels- et propriétés des produits. Les géologues doivent développer les outils qui permettront de caractériser le plus exhaustivement possible les minéraux et les phases carbonées trouvés dans la nature et ainsi potentiellement documenter les traces de vie les plus anciennes. Le domaine manque cruellement de biologistes qui grâce à des études de génétique, d’écologie et d’évolution permettront de mieux comprendre les mécanismes impliqués et leur signification pour l’histoire de la vie sur Terre. Les biosignatures existent-elles ? Je n’en suis pas sur, si l’on entend par là un critère unique et non ambiguë. En revanche, il est probable qu’une caractérisation la plus exhaustive possible des traces de vie potentielles permettant notamment une bonne compréhension des conditions physico-chimiques de formation, de la géométrie 3D des objets et une vision statistique de leur représentation aideront à ne pas refaire les erreurs commises précédemment et à avancer plus sûrement sur les traces de l’histoire de la Vie.
.
Bibliographie
Livres
- Baeuerlein, E., Biomineralization : From Biology to Biotechnology and Medical Application. Wiley-VCH, Weinheim, Germany, 2000.
Livre référence avec une grande partie consacrée aux magnétites bactériennes.
- Mann, S. Biomineralization : Principles and Concepts in Bioinorganic Materials Chemistry (Oxford Univ. Press,. New York, 2001).
Bien que moins complet que le précédent, il présente une approche chimique des processus assez intéressante.
- Dove, P.M. S. Weiner and J.J. De Yoreo (Eds.) Biomineralization. Reviews in Mineralogy and Geochemistry Mineralogical Society of America, Washington, D.C., v. 54, 2003.
Un recueil de revues très récentes. La partie consacrée aux microorganismes est bien sûr réduite.
- Riding, R.E. & Awramik, S.M. (Eds.), Microbial Sediments, 331 p. Springer-Verlag, Berlin-Heidelberg. (2000)
Recueil d’articles présentant en détail les objets comme les stromatolites et les phosphorites.
Articles
- Barber DJ, Scott ERD (2003) Transmission electron microscopy of minerals in the martian meteorite Allan Hills 84001. Meteoritics & Planetary Science 38 (6) : 831-848.
- Benzerara K., et al. Nanobacteria-like calcite single crystals at the surface of the Tataouine meteorite. Proc. Natl. Acad. Sci. USA 100, 7438-7442 (2003).
- Benzerara K., et al. (2004) Bacteria-controlled precipitation of calcium phosphate by R. tataouinensis. Earth Planetary Science Letters 228, 439-449.
- Blake RE et al. (2001) Oxygen isotope ratios of PO4 : An inorganic indicator of enzymatic activity and P metabolism and a new biomarker in the search for life. Proc. Natl. Acad. Sci. USA 98 (5) : 2148-2153.
- Blakemore R. (1975) Magnetotactic bacteria. Science 190 (4212) : 377-379. Premier article de description des bactéries magnétotactiques.
- Borg LE et al. (1999) The age of the carbonates in martian meteorite ALH84001. Science 286 (5437) : 90-94.
- Brasier MD et al. (2002) Questioning the evidence for Earth’s oldest fossils. Nature 416 (6876) : 76-81. Associé dans le même numéro à un article de Schopf, c’est LA remise en cause de ce qui était considéré comme les plus vieux fossiles microbiens sur Terre.
- Chang SBR et al. (1989) Biogenic magnetite in stromatolite. 2. occurence in ancient sedimentary environments. Precambrian Research 43 (4) : 305-315.
- Dalton R (2002) Microfossils : Squaring up over ancient life. Nature 417 (6891) : 782-784. Petit texte intéressant vis-à-vis de la controverse Schopf-Brasier qui semble dépasser le strict cadre scientifique.
- Delong EF, et al. (1993) Multiple evolutionary origins of magnetotaxis in bacteria. Science 259 : 803-806.
- Devouard B et al. (1998) Magnetite from magnetotactic bacteria : Size distributions and twinning. American Mineralogist 83 (11-12) : 1387-1398.
- Flies CB, et al. (2005) Combined approach for characterization of uncultivated magnetotactic bacteria from various aquatic environments. Applied and Environmental Microbiology 71 (5) : 2723-2731.
- Folk RL (1996) In defense of nannobacteria. Science 274 (5291) : 1288-1288.
- Golden DC et al. (2004) Evidence for exclusively inorganic formation of magnetite in Martian meteorite ALH84001. American Mineralogist 89 : 681-695. La remise en cause de la biogénicité des magnétites d’ALH84001.
- Grotzinger, J.P. & Rothman, D.H. An abiotic model for stromatolite morphogenesis. Nature 383, 423-425 (1996).
- Jull AJT et al. (1998) Isotopic evidence for a terrestrial source of organic compounds found in martian meteorites Allan Hills 84001 and Elephant Moraine 79001. Science 279 (5349) : 366-369.
- Kajander EO, Ciftcioglu N (1998) Nanobacteria : An alternative mechanism for pathogenic intra- and extracellular calcification and stone formation. Proc. Natl. Acad. Sci. USA 95 (14) : 8274-8279
- Kempe, S. et al. Largest known microbialites discovered in lake Van, Turkey. Nature 349, 605-608 (1991).
- Lopez-Garcia et al. (2005) Bacterial diversity and carbonate precipitation in the giant microbialites from the highly alkaline Lake Van, Turkey. Extremophiles, online.
- Lowenstam H.A. (1981) Minerals formed by organisms. Science 211 : 1126-1131. Article de référence en biominéralogie.
- McKay D.S. et al. Search for past life on Mars : Possible relic biogenic activity in Martian meteorite ALH84001. Science 273, 924-930 (1996). Article que l’on ne présente plus sur la découverte de vie fossile martienne dans la météorite ALH84001.
- Niles PB et al. (2005) Microscale carbon isotope variability in ALH84001 carbonates and a discussion of possible formation environments. Geochimica et Cosmochimica Acta 69 (11) : 2931-2944.
- O’Brien GW et al. (1981) Bacterial origin of east australian continental margin phosphorites. Nature 294 (5840) : 442-444
- Reid, R.P. et al. The role of microbes in accretion, lamination and early lithification of modern marine stromatolites. Nature 406, 989-992 (2000). Article de référence, quoique incomplet pour la formation des stromatolites.
- Schopf JW, Packer BM (1987) Early archean (3.3-billion to 3.5-billion-year-old) microfossils from Warrawoona group, Australia. Science 237 (4810) : 70-73. Premier article de description des microfossiles cyanobactériens à 3.5 Ga.
- Schuler D (2004) Molecular analysis of a subcellular compartment : the magnetosome membrane in Magnetospirillum gryphiswaldense. Archives of Microbiology 181 (1) : 1-7. Article de revue le plus récent sur la protéomique et génomique des magnétosomes.
- Stephan T et al. (2003) TOF-SIMS analysis of polycyclic aromatic hydrocarbons in Allan Hills 84001. Meteoritics & Planetary Science 38 (1) : 109-116.
- Thomas-Keprta KL, et al. (2002) Magnetofossils from ancient Mars : a robust biosignature in the Martian meteorite ALH84001. Applied and Environmental Microbiology 68 : 3663-3672.
- Thomas-Keprta KL, et al. (2001) Truncated hexa-octahedral magnetite crystals in ALH84001 : Presumptive biosignatures. Proc. Natl. Acad. Sci. USA 98 : 2164-2169.
- Vali H et al. (2004) Formation of tabular single-domain magnetite induced by Geobacter metallireducens GS-15. Proc. Natl. Acad. Sci. USA 101 (46) : 16121-16126.
- Vali H et al. (2001) Nanoforms : A new type of protein-associated mineralization. Geochimica et Cosmochimica Acta 65 (1) : 63-74.
- Van Dijk S et al. (1998) Purification, amino acid sequence, and cDNA sequence of a novel calcium-precipitating proteolipid involved in calcification of Corynebacterium matruchotii. Calcified Tissue International 62 (4) : 350-358.
- Weiss BP et al. (2004) Magnetic tests for magnetosome chains in Martian meteorite ALH84001. Proc. Natl. Acad. Sci. USA 101 (22) : 8281-8284.
__________________________________
L’auteur, Karim Benzerara, est chargé de recherche CNRS dans le groupe de Géobiosphère Actuelle et Primitive, à Institut de Minéralogie et de Physique des Milieux Condensés (Paris)







Aucun commentaire sur l'article Mécanismes de biominéralisation et biosignatures minéralogiques