Par Robert Pascal
.
L’eau n’est pas seulement un solvant, c’est aussi un réactif nucléophile qui va transformer des espèces activées en produits inertes par hydrolyse. La plupart des biopolymères et des biomolécules étant hydrolysables, les êtres vivants doivent utiliser des sources d’énergie ou consommer des espèces activées pour se maintenir loin de l’état d’équilibre thermodynamique (non-vivant) où ces espèces seraient hydrolysées. Il devait en être de même aux premiers stades de la vie, ce qui fonde une démarche visant à examiner si les réactions potentiellement prébiotiques répondent aux critères thermodynamiques et cinétiques pour pouvoir constituer un protométabolisme, ce qu’a récemment exprimé Arthur Weber (2002) : « At the earliest stage, primitive metabolism probably would have been a chemometabolic process consisting of chemically spontaneous reactions having favorable free energies and favorable rate constants. With a very limited ability to redistribute energy or catalyze kinetically unfeasible reactions, the synthetic pathways of early chemometabolism would have been shorter and less complex than those of modern metabolism. » Ces contraintes doivent donc constituer un crible pour valider la pertinence de réactions envisagées aux stages précoces de la vie et lors de l’évolution chimique antérieure.
.
Contenu énergétique des biomolécules et hydrolyse
.
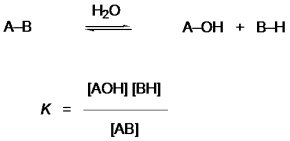
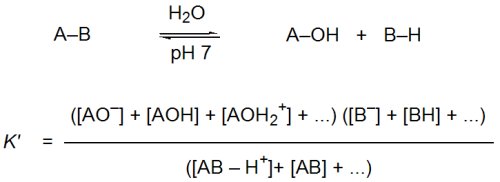
Le caractère riche en énergie des biomolécules hydrolysables peut être apprécié par leur affinité pour l’eau mesurée par leur équilibre d’hydrolyse :
.
.
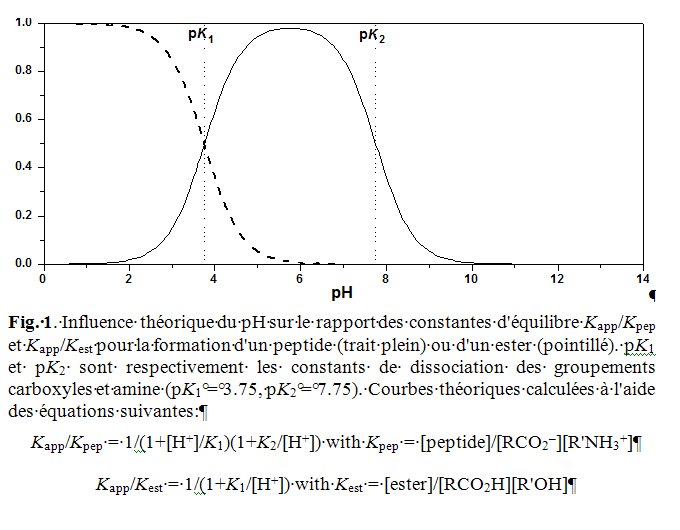
Mais, dans l’eau, l’état d’ionisation des espèces A–B, A–OH et B–H dépend souvent du pH à cause de la présence de fonctions acides ou basiques au sein de ces molécules. Si, par exemple, l’on forme une liaison peptidique (inverse de l’hydrolyse) à partir de deux segments peptidiques dont l’un porte la fonction acide carboxylique terminale [pKa (COOH) 3,5–4] et l’autre la fonction amine [pKa (NH3+) 7,5–8]. La constante d’équilibre Kpep se référant aux espèces considérées dans la partie gauche de l’équation est d’une utilité limitée car la zone de pH où ces deux formes sont majoritaires correspond à une gamme réduite (pH ≈ 4–7).
.
En conséquence, la constante d’équilibre apparente Kapp, relative à la somme des concentrations des espèces sous forme acide et basique, va dépendre du pH (Fig. 1). C’est pourtant cette constante apparente qui nous intéresse car elle concerne des espèces chimiques isolables (le peptide et les segments) indépendamment de leur état effectif d’ionisation. La liaison peptidique est donc totalement instable en milieu acide et basique, elle l’est beaucoup moins entre pH 5 et pH 7. Une norme est nécessaire pour pouvoir comparer le contenu énergétique de différentes espèces ; l’usage est de considérer seulement les valeurs des constantes d’équilibre apparentes K’ en se plaçant à pH 7. Mais il faut garder à l’esprit que les conclusions obtenues de ces comparaisons sont uniquement valables dans ce contexte. Ces constantes d’équilibre sont calculées en considérant la concentration totale des espèces en jeu sans tenir compte de leur état d’ionisation :
.
.
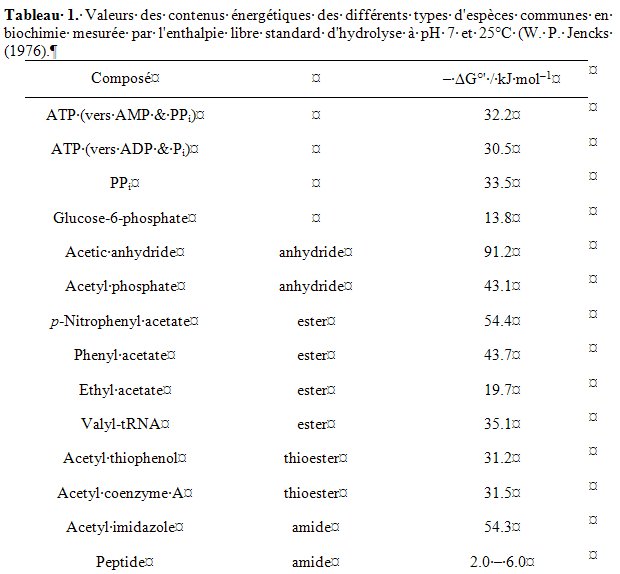
Le contenu énergétique d’une biomolécule sera alors chiffré par définition à l’aide de son enthalpie libre d’hydrolyse à 25°C et pH 7. deltaG°’ = – RT ln K’ Le caractère typographique ’ (prime) dans G°’ exprime simplement que l’activité de H+ considérée (a(H+) = 10–7 M à pH 7) ne correspond pas à l’état standard (1M). Les ouvrages de biochimie donnent généralement un tableau rassemblant les valeurs usuelles importantes en biochimie (Tableau 1). Ces valeurs permettent de définir des liaisons « riche en énergie » (anhydrides, thioesters, ATP, etc.) et d’autres, relativement pauvres, comme les esters d’acide phosphoriques, les esters et les peptides (amides). Une autre caractéristique de ce contenu énergétique est sa capacité à être transféré par des réactions chimiques couplées dans une chaîne métabolique.
.
.
Activation biochimique des acides aminés
.
L’activation des acides aminés en biologie est liée à la traduction du code génétique qui est universel. C’est donc un des vestiges les plus ancestraux de la biologie. Elle met en jeu différentes espèces, l’adénosine triphosphate (ATP), l’aminoacyl-adénylate (AA-AMP) , l’adénosine 5’ monophosphate (AMP), le pyrophosphate (PPi), l’ARN de transfert (tRNA) et l’ARN de transfert aminoacylé (AA-tRNA) :
.
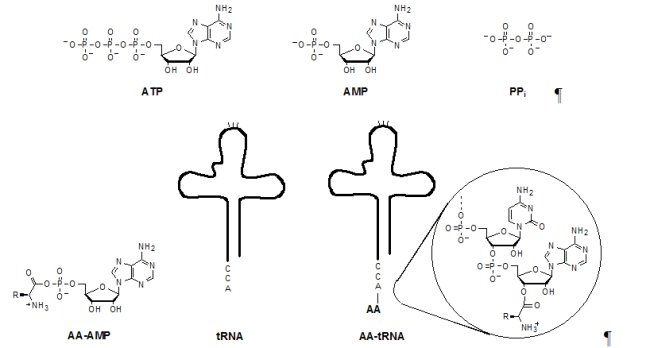
Elle s’effectue en deux stades :
.
.
Ce système repose sur une famille d’enzymes, les aminoacyl-tRNA synthétases (aaRS), dont la sélectivité lors de l’aminoacylation (fixation d’un acide aminé sur le tRNA portant le triplet de bases correspondant) est la clef de la fidélité dans la traduction du code génétique. Du point de vue énergétique, l’enzyme stabilise les espèces instables (en particulier l’anhydride AA-AMP). Cette stabilisation a pour résultat « d’égaliser » les niveaux énergétiques des espèces mises en jeu ; la formation de l’aminoacyl adénylate sous forme liée à l’enzyme est alors très proche de l’équilibre (Holler and Calvin, 1972) :
.
.
Mais cette stabilisation de l’AA-AMP par l’enzyme résulte d’une optimisation par l’évolution. Une des questions essentielles pour comprendre l’émergence du code génétique est de savoir comment ce système sophistiqué a pu apparaître en l’absence d’enzymes et donc d’aaRS (avant l’émergence de la machinerie de traduction).
.
L’activation des acides aminés par l’ATP aux premiers stades est très improbable
.
Les contenus énergétiques des espèces mises en jeu lors de l’activation biochimique des acides aminés ont été réunis et/ou estimés pour les formes libres en solution aqueuse (Tableau 2).
.

La différence entre les contenus énergétiques de l’ATP et de l’adénylate AA-AMP indiqués dans le tableau 2 est de 33 kJ mol–1. Il est possible d’en déduire que l’activation des acides aminés par l’ATP (ou d’ailleurs d’autres polyphosphates) est fortement improbable hors du contexte de l’aminoacyl-tRNA synthétase qui stabilise l’anhydride mixte car l’équilibre entre les espèces libres en solution est fortement défavorable (K ≈ 10–6–10–5, contre K 1 dans le site actif de l’aaRS).
.

Il reste donc à trouver une explication à l’émergence de ce chemin réactionnel métabolique qui ne répond pas au critère attendu pour une réaction spontanée malgré son rôle essentiel en biologie et son apparition précoce, probablement simultanée de celle de la traduction du code génétique.
.
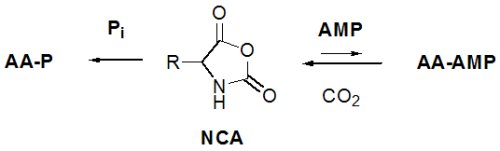
Les NCA comme précurseurs des anhydrides mixtes AA-AMP ?
.
Le plus logique est de faire l’hypothèse que les AA-AMP se sont formés initialement par une autre voie, différente de la voie moderne, qu’ils ont trouvé une utilité en contribuant au fonctionnement des tout premiers êtres vivants et qu’ensuite ils ont été stabilisés par des enzymes. Reste à identifier leurs précurseurs qui doivent avoir un contenu énergétique voisin ou supérieur au leur (–deltaG°’ 65 kJ mol–1). L’examen du tableau 2 montre qu’une espèce possède le niveau énergétique requis : le N-carboxyanhydride d’acide aminé (NCA : –deltaG°’ 60 kJ mol–1). La réactivité des NCA avec le phosphate inorganique (Biron et al., 2004) et avec les nucléotides (Biron et al., 2005) a récemment démontré la possibilité d’une voie alternative de synthèse des AA-AMP.
.
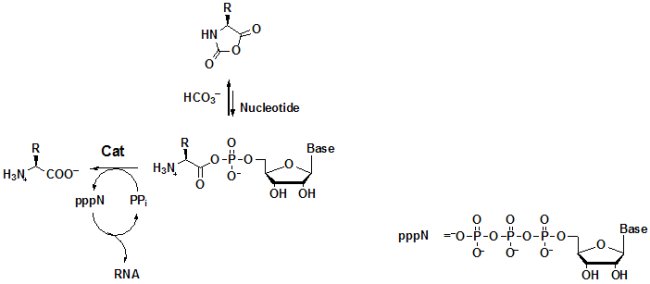
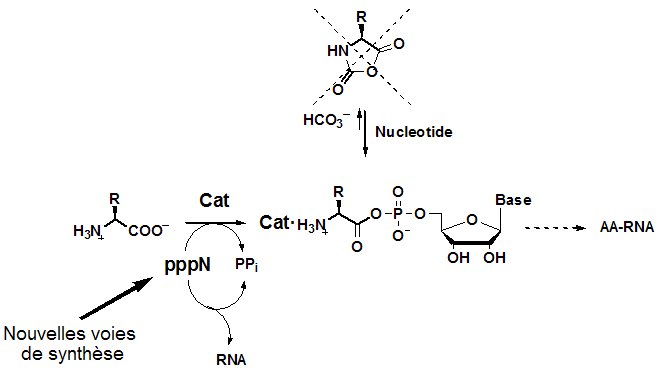
L’utilité des adénylates AA-AMP aux stades précoces pourrait résider, non pas dans la synthèse de peptides non-codés (les NCA sont capables de le faire bien plus aisément), mais dans l’activation des nucléotides, par exemple sous forme de triphosphate (pppN).
.
.
Cette formation de nucléosides triphosphates est l’inverse de l’activation des acides aminés par l’ATP rejetée précédemment comme improbable, elle se déroule donc ici dans le sens thermodynamique favorable (bien que nécessitant sans doute un catalyseur, Cat). La synthèse possible d’ARN à partir de ces nucléotides activés (et sa réplication) pourrait être la force motrice expliquant l’évolution du système vers des catalyseurs stabilisant l’anhydride mixte (enzymes ou ribozymes) et améliorant son efficacité globale. La voie moderne aurait ensuite résulté de l’apparition de synthèses alternatives des nucléosides triphosphates (en particulier l’ATP) causant un renversement du flux réactionnel et rendant ainsi les premiers êtres vivants indépendants des synthèses abiotiques de NCA (désormais inutiles).
.
.
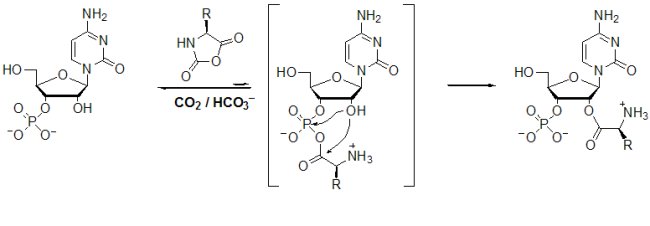
Un autre argument qui plaide en faveur d’un rôle des NCA dans l’apparition de la machinerie de traduction du code génétique (ribosome, ARN de transferts) est leur possibilité de réaction spontanée avec les nucléosides phosphorylés en position 3’ (Biron et al., 2005) :
.
Les nucléotides 2’-aminoacylés formés ont une structure ressemblant à celle des ARN de transfert chargés en acide aminé AA tRNA. Il est raisonnable d’avancer l’hypothèse qu’ils pourraient en être les précurseurs.
.
Les NCA comme degré prébiotique maximal d’activation des acides aminés et comme transporteurs d’énergie
.
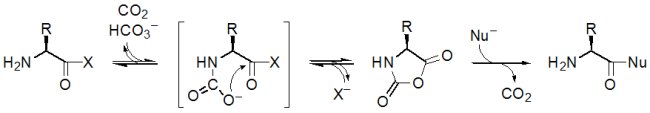
Les acides aminés activés sont très facilement convertis en NCA s’ils ont un niveau énergétique suffisant (Brack, 1987) :
En raison de la présence quasi certaine de CO2 dans l’atmosphère primitive, ceci veut dire que tout autre espèce de contenu énergétique supérieur (–deltaG°’ ≥ 60 kJ mol–1) aurait été convertie en NCA. Le fait que l’évolution ait conservé les adénylates AA-AMP comme degré maximal d’activation des acides aminés en biologie est cohérent avec ce dernier point ; ces espèces ont en effet un niveau énergétique proche de celui des NCA et leur interconversion avec eux est aisée et spontanée (ne nécessitant pas de catalyseur). Les NCA dont l’intervention comme forme activée des acides aminés pourrait être responsable d’une formation dynamique de peptide non codés (Commeyras et al., 2003) auraient donc joué un rôle beaucoup plus étendu.
.
Conclusion
.
Toute voie chimique potentiellement prébiotique doit être considéré sous l’angle de sa pertinence thermodynamique. En ce qui concerne l’activation des acides aminés, les contraintes thermodynamiques rendent la voie biochimique moderne quasiment irréalisable en l’absence d’un catalyseur évolué. Le fait de tenir compte des contraintes thermodynamiques, donc d’accepter que la conversion entre AA-AMP, d’un côté, et ATP et acide aminé, de l’autre, s’est déroulée tout d’abord dans le sens inverse de celui observé en biochimie, ouvre la possibilité d’une évolution graduelle ne nécessitant aucune discontinuité pour arriver au système moderne.
.
Références
.
- Biron, J.-P. and Pascal, R. (2004), Amino Acid N-Carboxyanhydrides : Activated Peptide Monomers Behaving as Phosphate-Activating Agents in Aqueous Solution, J. Am. Chem. Soc. 126, 9198–9199.
- Biron, J.-P., Parkes, A. L., Pascal, R., and Sutherland, J. D. (2005) Expeditious, Potentially Primordial, Aminoacylation of Nucleotides, Angew. Chem. Int. Ed. 44, sous presse.
- Brack, A., (1987), Selective emergence and survival of early polypeptides in water, Origins Life 17, 367-379.
- Commeyras, A.et al. (2003), Approche dynamique de la synthèse des peptides et leurs précurseurs sur la Terre primitive, In Gargaud, M., Despois, D., Parisot, J.P., – Reisse, J. (Eds) Les traces du vivant, Presses Universitaires de Bordeaux, Bordeaux, pp. 115-162.
- Holler, E., Calvin M. (1972), Isoleucyl Transfer Ribonucleic Acid Synthetase of Escherichia coli B. A Rapid Kinetic Investigation of the L-Isoleucine-Activating Reaction, Biochemistry 11, 3741-3752.
- Jencks, W. P. (1976), Free energies of hydrolysis and decarboxylation, In : Fasman, G. D. (ed) Handbook of Biochemistry and Molecular Biology, 3rd edn, Vol I Physical and Chemical Data. CRC Press, Cleveland, pp. 296-304).
- Pascal, R., Boiteau, L., Commeyras, A. (2005), From the Prebiotic Synthesis of -Amino Acids Towards a Primitive Translation Apparatus for the Synthesis of Peptides, Top. Curr. Chem., 259, 69-122.
- Weber, A. L. (2002), Chemical constraints governing the origin of metabolism : the thermodynamic landscape of carbon group transformations under mild aqueous conditions, Origins Life Evol. Biosphere, 32, 333-357.
_______________________________
L’auteur Robert Pascal est membre du GDR exobiologie, est chargé de recherche au Laboratoire : Organisation moléculaire, Evolution & Matériaux Fluorés, dans le groupe de recherche Dynamique des Systèmes Biomoléculaires Complexes du CNRS.
.






Aucun commentaire sur l'article Conditions énergétiques gouvernant l’activation biochimique des acides aminés