Source CNRS, site de l’Institut National de Chimie
La synthèse chimique de peptides (petites chaines d’acides aminés) requiert des agents d’activation. Il en a certainement été de même pour la formation de peptides nécessaires à l’origine de la vie sur Terre, mais bien sûr aucun des réactifs d’activation couramment utilisés au laboratoire ne pouvait être présent. Une recherche menée en collaboration impliquant trois équipes(*) vient de mettre en évidence que le cyanamide (H2N–CN) est capable de jouer un tel rôle, probablement après une conversion lente en son isomère, le carbodiimide (HN=C=NH, le composé parent le plus simple de la famille correspondante d’agents d’activation). Ces travaux font l’objet d’une publication dans la revue Angewandte Chemie.
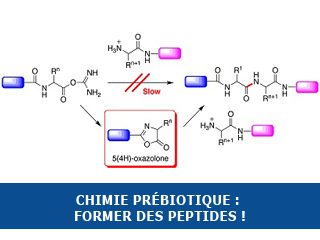
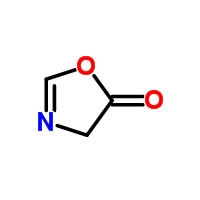
L’originalité de ce travail réside dans la voie chimique menant à la formation de peptides en présence de ce réactif en solution aqueuse. Cette réaction a été étudiée à l’aide d’un carbodiimide soluble dans l’eau, et reste possible même en solution diluée. La formation transitoire d’un intermédiaire dérivé du cycle 5(4H)-oxazolone explique l’efficacité de cette voie menant à des peptides de longueur dépassant pour certains une dizaine de résidus(**). Grâce à cette voie, le groupement carboxyle C-terminal des peptides peut être activé dans l’eau en solution diluée, et donner lieu à un couplage peptidique dans des conditions où les réactions d’acides α-aminés libres, ou celle d’autres acides, sont quasiment non-détectables.
Des expériences analogues menées en remplaçant le carbodiimide hydrosoluble par le cyanamide démontrent un comportement équivalent pour ce dernier même si les réactions sont beaucoup plus lentes. Cette voie permettrait d’expliquer la formation abiotique de peptides en milieux aqueux sur la Terre primitive à partir du cyanamide, agent d’activation simple dont la formation a été observée dans le milieu interstellaire. Cette voie pourrait donc avoir contribué à la chimie prébiotique des acides aminés et des peptides en prenant une place de choix parmi les voies d’activation d’acides aminés déjà mises en évidence.
Mais cette voie d’activation présente une caractéristique supplémentaire qui mérite d’être signalée. La formation de la 5(4H)-oxazolone explique aussi le degré élevé de racémisation constaté. Cette espèce est bien connue en synthèse peptidique en solvant organique, où elle est redoutée car cette oxazolone constitue la source principale de perte de l’intégrité chirale des peptides lors de leur préparation. Cependant, dans le contexte de la chimie prébiotique, les acides aminés de départ produits par des voies abiotiques sont généralement obtenus sous forme racémique (un mélange statistique des deux isomères optiques(***)). La racémisation n’est donc pas à craindre, bien au contraire, car elle pourrait jouer un rôle dans l’émergence de l’homochiralité. En effet, si l’épimérisation(****) du résidu activé permet de reproduire la configuration chirale du résidu voisin, le processus pourrait alors permettre une amplification de la chiralité au sein du polymère peptidique formé.
(*) Institut des Biomolécules Max Mousseron (CNRS / Université Montpellier 1 & Université Montpellier 2), Spectrométries et Dynamique Moléculaire, Physique des Interactions Ioniques et Moléculaires (CNRS / Aix-Marseille Université), Department of Earth and Planetary Sciences, Harvard University.
(**) Les peptides sont classés selon le nombre d’unités d’acides aminés dans une chaîne. Chaque unité est appelée résidu.
(***) Aussi appelés énantiomères, les isomères optiques sont deux molécules qui sont l’image l’une de l’autre par un miroir et ne sont pas superposables.
(****) Changement de configuration d’un centre d’asymétrie en configuration énantiomérique sans transformations dans le reste des centres d’asymétrie de la molécule.
Pour en savoir plus :
Grégoire Danger, Arthur Michaut, Manon Bucchi, Laurent Boiteau, Justine Canal, Raphaël Plasson, Robert Pascal, 5(4H)-Oxazolones as Intermediates in the Carbodiimide- and Cyanamide-Promoted Peptide Activations in Aqueous Solution, Angewandte Chemie International Edition 2012, DOI : 10.1002/anie.201207730 (article, accès soumis à conditions d’abonnements)




Aucun commentaire sur l'article Chimie prébiotique : coupler les acides aminés pour former des peptides