Comptes Rendus Palevol, Volume 2, Issues 6-7, October-November 2003, Pages 485-501
Par Frances Westall
« La vie a donc débuté avec un mode bactérien statistique. Ce mode bactérien s’est maintenu jusqu’à aujourd’hui et se maintiendra éternellement, du moins jusqu’à l’explosion du Soleil et la destruction de la Terre…comment affirmer que le progrès fournit la dynamique génératrice de l’évolution, alors que le mode de la complexité n’a jamais changé ?… Le paradigme du succès de la vie a de tout temps été la bactérie ».
Stephen Jay Gould, 1997. L’éventail du vivant, Éditions du Seuil, Paris, p. 210.
1. Introduction
Dans le vaste domaine de l’évolution, Stephen Jay Gould et son collègue Niles Eldredge ont avancé une hypothèse [7] qui a bouleversé les idées couramment admises et provoqué une vive polémique. Selon eux, au lieu d’être une progression continue et graduelle, l’évolution est faite d’équilibres poncturés : celle-ci est souvent marquée par des périodes très longues de stase avec peu de variation dans les espèces, périodes d’équilibre qui sont ponctuées par des périodes géologiquement courtes où les changements évolutifs (la spéciation) sont rapides. Nullement impressionné par la forte critique suscitée par sa vision de l’évolution, Gould persista dans la provocation, en suggérant qu’il y a un aspect aléatoire important dans l’évolution des populations en état de crise avant que celles-ci ne s’adaptent par le biais de la sélection naturelle. En ce qui concerne la sélection naturelle, comme l’explique Armand de Ricqlès [[35], p. 27], « Gould ne conteste nullement l’importance décisive de la sélection naturelle, mais seulement le caractère absolu du déterminisme sélectif et du principe corrélatif d’adaptationnisme. » Ricqlès résume la pensée gouldienne « Le cheminement évolutif est donc compris comme résultat de la juxtaposition, à tous les niveaux, de phénomènes de déterminisme sélectif et d’une composante aléatoire » [[35], p. 30].
Reprenant les théories de Gould dans le but de prédire les types d’organismes et les niveaux d’évolution susceptibles de se développer sur d’autres planètes, Knoll et Bambach [19] ont élargi ces réflexions sur l’évolution. En ajoutant la complexité de l’éco-espace (« ecospace ») et « the multidimensional hypervolume of Hutchinsonian niche space » (d’après Hutchinson [13]), Knoll et Bambach [19] définissent chaque étape fondamentale dans l’évolution, appelée « méga-trajectoire » (terme emprunté à Maynard Smith et Szathmàry [29]), comme un élargissement de l’éco-espace nouvellement conquis. Les méga-trajectoires sont, dans l’ordre croissant des éco-espaces et dans l’ordre chronologique :
(1) le stade de l’origine de la vie jusqu’au dernier ancêtre commun universel ;
(2) la diversification des procaryotes (le terme procaryote désigne ici l’ensemble des Bactéries et des Archeae. Bien que possédant des génomes et des enveloppes cellulaires différentes, les organismes de ces deux grands domaines ont des morphologies semblables (à noter que Gould utilise le terme « bactéries » pour désigner l’ensemble des Bactéries et des Archaea, une terminologie n’a plus cours, aujourd’hui) ;
(3) la diversification des eucaryotes unicellulaires ;
(4) la diversification des organismes multicellulaires aquatiques ;
(5) l’invasion des terres émergées ;
(6) l’ère de l’intelligence.
Vue de cette manière, l’évolution semble suivre une direction bien définie. De plus, une butée droite peut être ajoutée à la butée gauche de la complexité des organismes ; celle-ci représentera les limites structurales ou biochimiques des possibilités d’évolution à chaque stade, limites qui pourraient, cependant, être dépassées au stade suivant [19]. Néanmoins, Knoll et Bambach [19] considèrent que le développement à l’intérieur des groupes d’organismes (diversification à la Gould [9]) est une partie importante de l’évolution. En effet, le passage d’une méga-trajectoire à la suivante, qui requiert le dépassement de la butée droite et l’invasion d’un nouvel éco-espace, peut être considéré comme une étape d’évolution ponctuelle, étape qui sera ensuite suivie par une diversification accrue dans le nouvel éco-espace. En d’autres termes et selon le modèle d’équilibres ponctués de Eldredge et Gould [7], la spéciation précède l’adaptation à des conditions nouvelles.
Le présent article porte sur la recherche de la butée gauche de l’évolution, à savoir les premiers vestiges de la vie dans les roches de l’Archéen inférieur d’Australie et d’Afrique du Sud, vieilles de 3,4-3,5 milliards d’années (Ga). Suivant une démarche chère à Gould, cette recherche est basée sur l’étude de la morphologie des microfossiles. Les microfossiles trouvés dans les cherts (silicates de type silex) de cette époque présentent une morphologie d’organismes unicellulaires de type procaryote, semblables à certains procaryotes modernes. Ces vestiges représentent un niveau d’évolution qui a déjà dépassé la première méga-trajectoire de Knoll et Bambach [19] (qui va de l’origine de la vie jusqu’au dernier ancêtre commun universel) et on se trouve déjà dans celle de la diversification des procaryotes. Voilà qui justifie pleinement la citation de Stephen Jay Gould, dans son livre Full House (L’Éventail du vivant, 1997) [9], donnée ci-dessus, citation dans laquelle il souligne la prééminence des procaryotes, du début de l’histoire de la vie sur Terre jusqu’à nos jours. Dans son hypothèse provocatrice, Gould propose que l’évolution de la vie sur Terre, l’espèce humaine incluse, ne représente, en fait, qu’une diversification, une variation sur le thème de la vie bactérienne. Gould explique sa vision sur la base de sept observations.
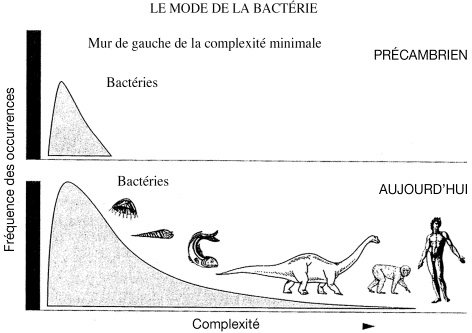
1) « La vie a nécessairement débuté au voisinage de la butée gauche [complexité minimale] (Fig. 1 ) » : autrement dit, les premières cellules avaient nécessairement une complexité minimale.
2) « Stabilité dans le temps du mode bactérien initial » : les espèces prépondérantes ont été les bactéries du début de l’histoire de la vie, jusqu’à aujourd’hui.
3) « La diversification de la vie engendre une distribution biaisée à droite [de la butée gauche de complexité minimale] » : à cause de la présence d’une limite de complexité minimale, il n’y a forcément qu’une direction possible de diversification, celle allant vers une complexité croissante.
4) « Une distribution entière ne peut pas être caractérisée uniquement par un élément extrême » : il y a une décroissance de la fréquence des espèces vers l’aile droite de la courbe de complexité car plus une espèce est complexe, moins elle est fréquente ; « ….les occupants de l’aile droite forment non une séquence évolutive, mais une farandole de formes disparates apparues au hasard, l’une après l’autre ».
5) « L’étalement de la courbe s’explique uniquement par l’existence de la butée gauche et la multiplication des espèces ; l’aile droite de la distribution est une conséquence et non une cause de cet étalement » : en effet, il n’y a que deux influences importantes sur la forme et l’évolution de la courbe de complexité : l’origine de la vie et le fait qu’il n’y ait qu’une direction d’évolution, celle allant vers la droite. Pour Gould, ce fait ne signifie pas nécessairement un progrès, « le fameux progrès dans l’histoire de la vie est ainsi un mouvement aléatoire éloignant les organismes de leurs minuscules ancêtres, et non une impulsion unidirectionelle vers une complexité fondamentalement avantageuse ».
6) « Il existe certes un moyen logique de réintroduire subrepticement le progrès dans un tel système, mais d’un point de vue empirique, il y a également une très forte possibilité d’échec » : dans le sens du temps, il y a plusieurs exemples d’une diminution de complexité, une régression vers la butée gauche de la complexité.
7) Dans son dernier commentaire, Gould souligne l’hypothèse selon laquelle l’espèce humaine n’est qu’un accident de la nature et non le résultat d’une évolution continue et implacable.
.
Fig. 1. Fréquence des espèces par rapport à leur complexité, soulignant
la proéminence des bactéries (figure d’après Gould [9]).
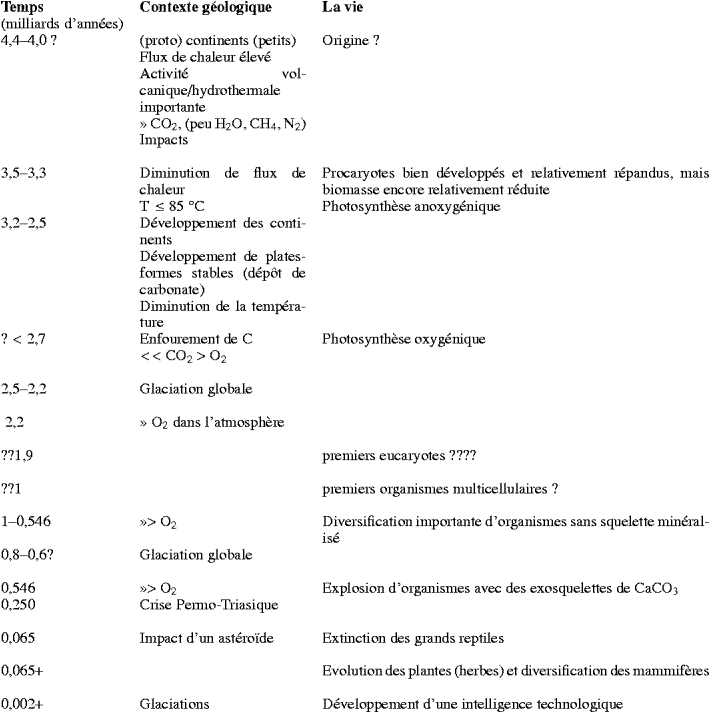
Dans son livre L’Éventail du vivant » [9], Gould souligne l’influence de la diffusion aléatoire sur l’évolution des organismes. En fait, celle-ci doit être comprise comme étant étroitement liée à l’apparition de nouveaux écosystèmes liés aux processus géologiques et biogéochimiques, l’influence de l’environnement et des changements dans l’environnement à l’échelle géologique étant très importante. Les processus géologiques coïncidèrent avec des développements importants du monde vivant, notamment l’apparition des eucaryotes et endosymbiontes, l’explosion des organismes à exosquelette de carbonate de calcium, l’apparition des chordés avec leurs endo-squelettes de phosphate de calcium, la crise du Permo-Triasique, l’apparition des plantes vasculaires, l’extinction des grands reptiles à la fin du Crétacé offrant aux mammifères une possibilité de diversification, etc. Il semble que, une fois mise en marche, l’évolution va vers plus de complexité, tant qu’elle n’est pas limitée par son environnement. Cette hypothèse pourra être partiellement vérifiée, lorsqu’on pourra comparer l’évolution de la vie terrestre à celle, encore hypothétique, de la vie sur Mars. L’évolution de la vie terrestre est étroitement liée à l’environnement de notre planète, qui a connu une évolution géologique continue, alors que celle de Mars s’est arrêtée relativement tôt dans son histoire. Les principales étapes concernant la Terre sont évoquées dans le Tableau 1.
.
Tableau 1. Les principales étapes de la vie terrestre.
Enfin, je partage l’analyse de Gould sur l’importance permanente du monde bactérien et la place extrêmement modeste occupée par l’espèce humaine sur l’échelle de l’évolution. D’autres auteurs ont également souligné l’importance de la présence continue des procaryotes dans la régulation des processus biogéochimiques de la planète (que quelques-uns appellent « respiration ») : c’est à cause du métabolisme bactérien que notre planète est viable pour les organismes plus complexes, comme, par exemple les eucaryotes et, notamment, l’espèce humaine. James Lovelock [23], Lynn Margulis et son fils Doron Sagan [28], suivis par Peter Westbroek [53] ont joliment décrit l’hypothèse de Gaia, la Terre vivante, dans laquelle les procaryotes jouent un rôle fondamental.
Afin de placer les premiers vestiges de vie dans leur contexte géologique et dans celui de l’évolution, les étapes principales dans l’évolution précoce de la Terre et la vie sont rappelées ci-après :
2. La vie terrestre
2.1. Le contexte géologique de l’évolution de la vie
La vie, dans sa forme cellulaire minimale, i.e. des molécules pouvant stocker et transmettre de l’information, capables de tirer leur énergie de l’environnement, et protégées par une membrane, a fait son apparition il y a plus de 3,5 milliards d’années (Ga), comme en témoignent les plus anciennes traces du vivant trouvées dans des roches de cet âge [46 and 51]. L’apparition de la vie est généralement considérée comme étant postérieure à 3,85 Ga, c’est-à-dire après la fin de la période de bombardement intense. On a calculé que le nombre d’impacts capable d’éradiquer toute forme de vie à la surface de la Terre avant 3,85 Ga était inférieur à six et peut-être même nul [26 and 41]. Certains auteurs suggèrent même que les impacts n’auraient pas obligatoirement éliminé la vie, même si celle-ci était apparue avant 3,85 Ga [38].
La Terre primitive consistait en de petits (proto)continents émergeant des rides océaniques et des panaches du manteau, et ressemblait probablement à l’Islande d’aujourd’hui. Une diminution graduelle du flux de chaleur provenant de la dégradation des éléments radioactifs du manteau, combinée à un fractionnement de la croûte, a dû produire graduellement une croûte plus rigide. Le processus de tectonique des plaques que nous connaissons aujourd’hui a dû se mettre en place pendant les premiers 1,5 Ga de la Terre, conduisant à des masses continentales entourées de grandes plates-formes et de bassins d’eau peu profonde. L’atmosphère de la Terre primitive était dominée par du CO2 avec un apport assez important de CH4 et des traces de N2 et d’H2O. Pendant l’Archéen supérieur et le Paléoprotérozoïque, le taux d’oxygène dans l’atmosphère a commencé à augmenter du fait de l’enfouissement du carbone (sous forme de biomasse organique et de dépôts de carbonates) dans les sédiments de l’océan, et puis dans le manteau, grâce à la tectonique de plaques [22]. La présence d’oxygène dans l’atmosphère a provoqué une chute de la température globale avec, en conséquence, un environnement instable. De nombreux indices montrent que la Terre pendant le Paléoprotérozoïque était presque complètement couverte de glace, comme l’est aujourd’hui Europe, le satellite de Jupiter. L’augmentation du CO2 volcanique dans l’atmosphère, provoquant un effet de serre, a contribué à faire sortir la Terre du régime glaciaire peu propice au développement de la vie.
2.2. La vie (jusqu’à l’apparition des eucaryotes)
La vie est apparue à des températures élevées sur une planète ne possédant pas d’oxygène libre dans l’atmosphère (voir [48] pour un résumé exhaustif des conditions environnementales de la Terre primitive). Cette vie était anoxique et, comme l’a écrit Gould [9], consistait en des cellules simples, dont les premiers vestiges, vieux de 3,5 Ga, devaient fort ressembler aux procaryotes actuels. L’étude des fragments de génomes invariants (le 16sRNA) a permis de remonter vers le dernier ancêtre commun : il semble qu’il s’agisse d’organismes thermophiles, ce qui suggère que la vie apparut au voisinage de sources hydrothermales. Les premiers organismes étaient probablement constitués de membranes (vésicules formées par l’agrégation spontanée de lipides) isolant du milieu aqueux les macromolécules nécessaires à la reproduction, comme, par exemple, l’ARN. Cette dernière molécule est plus simple que l’ADN et peut assumer à la fois une reproduction relativement fidèle ainsi qu’un certain nombre de réactions catalytiques. Cet organisme primitif a évolué par un processus de sélection naturelle [25]. Des protéines sont apparues graduellement dans les cellules primitives, peut-être complexées aux ARN, au début. Au fil du temps, ces complexes auraient été remplacés par des protéines isolées pour devenir les enzymes principaux de la cellule. Pour le stockage de l’information génétique, l’ADN a progressivement pris le relais de l’ARN, car cette molécule commet moins d’erreurs de copie et requiert même moins énergie. A un certain stade dans l’évolution de la cellule primitive, le système ADN-ARN-protéine s’est révélé être le meilleur processus pour la reproduction de l’information biologique. Ce système a été conservé jusqu’à nos jours par les cellules.
Tout organisme qui se réplique a besoin d’une source d’énergie et d’une source de carbone. Le moyen le plus simple pour obtenir de l’énergie chimique est la chimiolithotrophie. Au début, les organismes primitifs la tiraient probablement à partir du fer, qui était abondant sur la Terre primitive, par la réaction suivante : FeS+H2S→FeS2+H2↑, qui produit 42 kJ par réaction. Des métabolismes plus efficaces, mais qui requièrent un plus grand nombre de molécules catalytiques et une plus grande complexité biochimique, ont succédé à la chimiolithotrophie, comme, par exemple, la fermentation et la respiration anaérobie et, ensuite, la photosynthèse anaérobie.
Il y a probablement eu deux sources de carbone : initialement, le carbone organique produit par la synthèse prébiotique et, plus tard, celle obtenue à partir du CO2, par autotrophie de type photosynthèse.
L’expression « sélection naturelle » est souvent utilisée pour qualifier l’évolution de la vie primitive. Il y a cependant une différence fondamentale entre les procaryotes et les eucaryotes et l’évolution des deux groupes doit être traitée séparément [21 and 28]. Les procaryotes sont des organismes haploïdes : ils se répliquent par scissiparité (ou fissiparité) binaire. Chaque descendant résultant de cette division a exactement les mêmes gènes que son parent, ce qui entraîne un taux relativement bas de recombinaison des chromosomes. Cependant, les procaryotes peuvent échanger leurs gènes, même entre espèces, par un processus qualifié d’échange horizontal (lateral gene exchange) et on pense que celui-ci était extrêmement fréquent dans la vie primitive. Le matériel génétique des procaryotes est donc très flexible et versatile [28], ce qui leur permet d’évoluer rapidement et de s’adapter rapidement aux changements de l’environnement. Les eucaryotes, par contre, ont un taux de recombinaison des gènes très élevé ; le processus de combinaison des ADN de deux parents est appelé meiose. Selon Margulis et Sagan [28], l’origine des espèces remonte seulement à l’introduction de la meiose chez les organismes.
Pour revenir aux premiers vestiges de la vie à 3,5 Ga, les micro-organismes fossilisés se trouvaient au niveau de la butée gauche de la complexité de la vie. Leur diversité était étonnante (j’y reviendrai plus loin) : on trouve des mattes bactériennes dans tous les environnements préservés (bassins peu profonds, zone littorale, aux abords des sources hydrothermales, dans des eaux alcalines et salines, etc.) et la photosynthèse anoxique était déjà active [52]. Pourtant, la biomasse de la Terre est restée relativement réduite, parce que les métabolismes anoxiques ne permettent pas une grande productivité. Il fallait un saut dans l’évolution pour arriver à un autre type de métabolisme, beaucoup plus efficace pour tirer l’énergie de l’environnement, la photosynthèse oxygénique. Le métabolisme oxygénique est assez complexe : il est utilisé dans le monde bactérien, en particulier par le groupe des cyanobactéries. Celles-ci, très répandues dans le Protérozoïque, sont probablement apparues pendant l’Archéen supérieur [16 and 43]. Il semble que l’abondante présence d’habitats d’eaux peu profondes et ensoleillées fût particulièrement propice à leur développement. Ces habitats se trouvaient sur les plates-formes nouvellement constituées autour des continents, résultant de la cratonisation graduelle des proto-continents. Avec l’évolution de la photosynthèse oxygénique, la biomasse a augmenté et la biosphère a commencé à prendre la place très importante qu’elle occupe actuellement.
L’oxygène, un produit de la photosynthèse oxygénique était un poison pour la plupart des espèces vivantes à l’époque, mais indispensable à la vie eucaryote. Il est extrêmement difficile de situer l’apparition des eucaryotes sur la base de leurs traces fossiles car, à leurs débuts, les eucaryotes ne présentaient pratiquement pas de différences morphologiques avec les procaryotes. Ces premiers eucaryotes, similaires en structure à des procaryotes, n’auraient pas encore développé les mitochondries, les chloroplastes et le noyau isolé par une membrane qui sont caractéristiques des eucaryotes évolués. Les premiers vrais eucaryotes devraient être le résultat des symbioses entre des procaryotes et les eucaryotes primitifs [27]. Les premiers vestiges des eucaryotes, identifiés sur la base de leur grande taille, remontent à 1,9 Ga [10]. Il existe une coïncidence remarquable entre les événements géologiques (environnementaux) et l’évolution de la vie : taux d’oxygène plus élevé dans l’atmosphère, fin des conditions environnementales sévères (glaciations globales entre 2,5 et 2,2 Ga, [17]) et apparition des eucaryotes. Mêmes si les microfossiles de Han et Runnegar [10] ne sont pas des eucaryotes, il est néanmoins incontestable que la vie eucaryote était fondée sur l’oxygène et ne pouvait donc pas se développer de façon importante tant que la teneur en oxygène n’était pas suffisante dans l’atmosphère.
3. La vie hypothétique de Mars
3.1. L’évolution géologique de Mars
D’une certaine façon, Mars a suivi une évolution géologique similaire à celle de la Terre, ce qui permet de penser que la vie a pu y apparaître. Il y a, cependant, des différences fondamentales qui vont jouer sur une éventuelle évolution (ou absence d’évolution) de la vie unicellulaire sur Mars. A l’inverse de la Terre, il semble que la planète Mars n’ait jamais été couverte par un océan, bien que l’existence de l’eau à sa surface pendant les premiers 500-700 Ma de son histoire paraisse aujourd’hui incontestable [2]. De plus, il semble qu’il n’y ait pas eu de formation de proto-continents, ni de continents dans le sens de terres cratonisées entourées par des plates-formes, dont la formation requiert l’action combinée de la présence des océans et d’un fort recyclage de la croûte [4]. La planète Mars est plus petite que la Terre et a épuisé sa réserve d’éléments radioactifs à demi-vie relativement courte beaucoup plus rapidement que la Terre, provoquant ainsi une diminution rapide du flux de chaleur, un refroidissement de la planète, et l’arrêt de la dynamo électromagnétique qui produisait le champ magnétique [42]. L’atmosphère de CO2, peut-être avec des traces de CH4 et H2O, n’a probablement pas suffi à compenser l’activité réduite du jeune Soleil [15]. Il est probable que les étendues d’eau aient été couvertes de glace [5]. Entre 4,0 et 3,5 Ga, Mars a perdu la plus grande partie de son atmosphère (actuellement, il existe une atmosphère de 6 mbar, constituée principalement de CO2). Plusieurs phénomènes sont évoqués pour expliquer cette perte : l’érosion de l’atmosphère par la vague destructrice d’impacteurs pendant la période tardive de bombardement, la formation de dépôts de carbonates par l’altération des laves, et l’érosion de l’atmosphère par le vent ionique solaire (à cause de l’absence d’un champ magnétique protecteur) [14]. Sans la protection d’une atmosphère, l’eau de surface s’est sublimée. Les derniers résultats de la mission Mars Odyssey ont pourtant confirmé l’existence d’une cryosphère d’eau congelée importante au-dessous de la surface de Mars. Le radar qui équipe l’orbiteur de Mars Express devrait confirmer ce résultat.
3.2. La vie martienne hypothétique
Avec les mêmes ingrédients que sur Terre (des molécules organiques, de l’eau liquide et une source d’énergie, soit hydrothermale, soit solaire), il n’y a pas de raison pour que la vie ne soit pas apparue sur Mars. L’absence d’un océan global n’était pas fondamentale ; il suffisait d’avoir de l’eau liquide au voisinage de sources hydrothermales, qui devaient être fréquentes sur la jeune planète, quand le flux de chaleur intérieur et le flux d’impacteurs étaient plus élevés. La date d’apparition de la vie martienne, par rapport à celle du bombardement intensif, est cruciale. Si la vie est apparue avant 4,0 Ga, ce qui est théoriquement possible du fait du refroidissement plus rapide de Mars, elle risquait fort d’être détruite pendant le bombardement. Aurait-elle pu apparaître après 3,85 Ga ? La planète subissait déjà une dégradation de son environnement. Il y avait cependant toujours des habitats possibles avec de l’eau liquide autour des zones à activités volcanique et hydrothermale (provoquée aussi par les impacteurs). Ces zones isolées favorables n’avaient pas une durée suffisante pour permettre le développement d’une hypothétique vie martienne. Dans le cas où la vie serait apparue après 3,85 Ga, elle aurait forcément dû débuter sur la butée gauche de la complexité de Gould. Il est impossible qu’elle ait pu se développer au-delà d’un stade très primitif, parce que la planète était en train de cesser son activité géologique. Nous avons souligné ci-dessus le caractère indispensable d’une activité géologique continue pour maintenir un environnement convenable pour la vie et pour créer des habitats propices à l’évolution d’organismes avec un métabolisme nouveau et plus complexe. Ce processus n’a pas eu lieu sur Mars. Si la vie martienne hypothétique n’a pu trouver refuge dans le sous-sol congelé, et se maintenir dans cet état jusqu’à aujourd’hui, elle est maintenant éteinte.
4. Le monde des procaryotes et sa diversité sur la Terre primitive
4.1. Les sédiments les plus anciens et la Terre primitive
Jusqu’à récemment, les cherts (silex), les banded iron formations (BIFS – formation de roches de fer rubané), les turbidites et les conglomérats du complexe Isua/Akilia dans le Sud-Ouest du Groenland (Fig. 2 ), d’âge compris entre 3,7 et 3,8 Ga, étaient considérés comme les sédiments terrestres les plus anciens [1]. Pourtant, une série de nouveaux travaux de terrain et de laboratoire ont démontré que les « sédiments » de Isua/Akilia, un terrain hautement métamorphisé, parfois jusqu’au faciès granulite, n’étaient pas des éléments sédimentaires [8 and 32]. Les sédiments les plus anciens connus à ce jour se trouvent donc dans les ceintures de roches rubanées de Barberton dans l’Est de l’Afrique du Sud (à la frontière avec le Swaziland) et dans le Nord-Ouest de l’Australie, dans le Pilbara (Fig. 2). Ces roches sont généralement peu métamorphisées (faciès prehnite-pumpellyite et parfois schistes vertes) et extrêmement bien conservées. Les informations que ces sédiments mous nous fournissent concernant les conditions environnementales de la Terre primitive, décrites plus haut, indiquent un environnement extrême, comparé aux conditions de la Terre actuelle : des terres émergées de taille réduite ressemblant à l’Islande, avec des bassins peu profonds (voire des lagunes), des températures plus élevées (jusqu’à 85 °C), une forte activité volcanique et hydrothermale, une atmosphère dominée par le CO2 (avec d’autres gaz comme par exemple CH4, N2, H2O sous forme vapeur ….), et un flux élevé de rayons UV (probablement en partie absorbé par la présence d’aérosols et de méthane d’origine volcanique) [52].
.
Fig. 2. Localisation des terrains de l’Archéen inférieur mentionnés dans le texte.
4.2. Les traces de vie les plus anciennes [48]
Jusqu’à récemment, les traces de vie les plus anciennes, vieilles de 3,7 à 3,8 Ga, reposaient sur des signatures des isotopes du carbone et des vestiges de procaryotes qui ont, ainsi que de levures, qui ont été trouvés dans les roches d’Isua [30, 32, 33, 34, 36, 40 and 37]. La nature sédimentaire des protolithes des ces roches très métamorphisées est actuellement contestée. De plus, des travaux récents apportent d’autres explications pour le signal isotopique et pour les structures « biologiques » observées. Il semble que les processus métasomatiques, liés au métamorphisme, puissent produire du carbone sous forme de graphite à partir de la décrépitation de sidérite [20 and 44]. Par ailleurs, Westall et Folk [49] ont montré que les roches contenant les prétendus microfossiles étaient contaminées par des micro-organismes endolithiques récents, observation confortée par la détection de contaminations dans les analyses des isotopes du carbone [44]. En conclusion, il semble donc qu’il n’y ait pas de preuves de vie à 3,7 ou 3,8 Ga dans les roches de Isua/Akilia au Groenland.
Cela dit, il est néanmoins vraisemblable que la vie ait déjà existé à l’époque de la formation des protolithes des roches d’Isua/Akilia, qu’elle ait été bien établie et relativement évoluée, comme le montre l’étude d’échantillons légèrement plus jeunes des ceintures de roches vertes de Barberton et du Pilbara. En effet, van Zuilen et al. [44] constatent l’existence probable d’un signal biogène endogène, malgré la contamination, dans un des échantillons d’Isua [37] qu’ils ont analysé. Les niveaux d’évolution et de diversification démontrés par la vie à 3,5 Ga posent obligatoirement la question du temps nécessaire pour atteindre un tel niveau de complexité. Avec des ingrédients simples, il est possible que la vie ait pu apparaître, dès que l’eau s’est condensée à la surface de la croûte à une température inférieure à 100°C. L’analyse des cristaux de zircon suggère que l’eau existait déjà à la surface de la Terre il y a 4,4-4,3 Ga [31 and 54]. L’effet des impacts sur l’origine et la survie des microorganismes primitifs a fait récemment l’objet d’un débat. Pour certains auteurs, la période de bombardement intense (heavy bombardment period) a diminué d’une manière régulière jusqu’à 3,85 Ga [11], tandis que d’autres auteurs situent le flux maximum entre 4,0 et 3,85 Ga [39]. Sleep et al. [41] ont calculé qu’il a pu y avoir, dans les premiers 500 à 750 Ma, entre 0 et 6 impacts suffisamment importants pour évaporer les océans et, ainsi, détruire la vie. Au contraire, Ryder [38] constate que, pendant le/les impact(s) le(s) plus fort(s), au maximum 400 m seulement des eaux auraient pu se volatiliser. Dans tous les cas, une possibilité de survie existait dans des zones protégées, comme par exemple au voisinage des sources hydrothermales.
5. Les premières traces de vie dans des cherts datés de 3,3 à 3,5 Ga
La diversité de la vie procaryote dans les roches sédimentaires les plus anciennes (vieilles de 3,3 à 3,5 Ga) et les mieux préservées, de Barberton en Afrique du Sud et du Pilbara en Australie, est étonnante. Les sédiments de Barberton et du Pilbara, composés de cendres, de clastes volcaniques et de précipitations hydrothermales, représentent des dépôts authigènes formés dans des bassins peu profonds autour de petits (proto)continents qui, à l’époque, n’avaient pas de plates-formes continentales. Les sédiments se sont également déposés sur les terres dans les zones littorales et sur les talus fluviaux. Les précipitations hydrothermales consistaient essentiellement en dépôts de silice mais on note aussi des dépôts de gypse, de barytine, de carbonates et de minerais de fer rubanés.
5.1. Les organismes
Des organismes présentant des ressemblances morphologiques avec des procaryotes actuels ont construit des mattes ou biofilms à la surface des sédiments déposés dans les bassins peu profonds et dans la zone littorale. Les morphologies de ces procaryotes fossiles incluent des formes en filament, vibrion, coque, chaîne de coques, et bâtonnet (Fig. 3 ) [46, 51 and 52]. Les microfossiles sont petits : les filaments ont quelques dizaines de micromètres de long et 0,25 à 0,5 µm de diamètre ; néanmoins, quelques rares exemplaires présentent des dimensions plus grandes : 100 µm de long (parfois même davantage) et jusqu’à 2,5 µm de diamètre ; les vibrions ont entre 2 et 3,8 µm de long avec des diamètres constants de 1 µm, tandis que les bâtonnets sont longs de 1 µm ; les coques, de 0,4 à 0,5 µm et de 0,9 à 1 µm de diamètre, se trouvent toujours en colonies et leurs diamètres sont constants. La plupart des microfossiles ont des surfaces rugueuses et un aspect effondré. Ceci indique que les organismes étaient déjà morts et partiellement dégradés avant d’être fossilisés. Les procaryotes fossiles forment des colonies de quelques individus à plusieurs dizaines d’individus, voire des centaines. Souvent les colonies consistent en des consortia regroupant plusieurs types d’organismes.
Fig. 3. Diversité de morphologie des bactéries fossiles de l’Archéen inférieur. (a) Colonie de bactéries vibrions (avec la permission d’Elsevier) ; (b) colonie de deux espèces de coques, une avec un diamètre de 0,8 µm et l’autre avec un diamètre de 0,4 à 0,5 µm, dont beaucoup sont en division cellulaire (flèches) ; (c) fragment d’une bactérie filamenteuse ; (d) coques en forme de chaîne (avec la permission d’Elsevier).
.
5.2. Les biofilms microbiens
En général, les organismes sont associés à des polymères (des polysaccharides ou extracellular polymeric substances – EPS) en forme de filaments fins ou de pellicules ([50 and 6] et les publications qui y sont citées). La formation d’un biofilm par les organismes comme les procaryotes est un phénomène très fréquent mais pas nécessairement obligatoire. La masse gélatineuse du biofilm sert de protection aux organismes et leur permet de réguler les conditions de pH et les concentrations en minéraux dissous dans leur micro-environnement. Dans des conditions sévères (flux forts, exposition à l’air et risque de dessèchement) , les biofilms peuvent atteindre des épaisseurs importantes, jusqu’à quelques millimètres, voire centimètres (Fig. 4 ). Dans des conditions de sécheresse, les couches extérieures des biofilms sont desséchées et les organismes meurent [45]. Elles forment ainsi une pellicule de protection pour les organismes vivants au-dessous. L’ensemble des procaryotes et des polymères forme un biofilm microbien qui piège aussi des particules clastiques (d’origine volcanique, hydrothermale ou même bactérienne avec des morceaux de biofilms re-sédimentés) et des minéraux authigènes comme, par exemple les argiles, la silice, les carbonates, les halogénures.
Fig. 4. Biofilms formés à la surface des sédiments (Archéen inférieur). (a) Biofilm épais formé et desséché dans la zone littorale ; (b) biofilm fin formé sous eau et consistant en une pellicule fine de polymère (pol), des filaments bactériens dégradés et des coques (flêche) (qui sont presque indifférenciables, à ce grandissement, des microcristaux de quartz).
Les biofilms ont des textures diverses selon l’environnement où ils se sont formés. En eaux calmes et protégées, ils peuvent être fragiles, consistant en de très fines pellicules de polymères liant les procaryotes. Par contre, les biofilms formés dans les zones littorales exposées à l’air, aux rayons UV, et au dessèchement, sont beaucoup plus épais et robustes. De plus, ces biofilms montrent des traces de dessèchement sous forme de craquelures de la pellicule et de précipitations de minéraux évaporitiques, comme par exemple la calcite, l’halite et la sylvite.
5.3. Les microbialites
Les microbialites sont des roches formées par l’activité microbienne. Les microbialites les mieux connues sont les stromatolithes. Les grands édifices microbiens, comme les stromatolithes spectaculaires du Protérozoïque sont inconnus à l’époque de l’Archéen inférieur. En revanche, il y plusieurs types de stromatolithes de petites dimensions. Hofmann et al. [12] ont décrit des structures coniques, hautes de 5 à 7 cm et larges de 8 à 10 cm, sur le site de North Pole au Pilbara (Fig. 5a,b ). D’autre part, Westall et al. [52] ont trouvé de petits stromatolithes en forme de dôme dans une autre localité du North Pole (Fig. 5c), tandis que des stromatolithes de grande longueur d’onde, avec de faibles amplitudes, ont été décrites à Barberton par Byerly et al. [3] ( Fig. 5d). Lowe [24] a pourtant souligné les risques d’interprétation erronée liés à des structures de forme « stromatoloïde » formées par des processus hydrothermaux non biologiques. Il est clair que, dans le voisinage de sources hydrothermales, les microbialites ont des apports hydrothermaux importants sous forme de dépôts minéraux. Cependant, au moins dans les cas décrits par Westall et al. [52] et Byerly et al. [3], les stromatolithes ont des textures clairement d’origine biologique.
Stromatolithes de l’Archéen inférieur. (a,b) Vue en section et plan d’un stromatoloïde en forme de cône cf. [33] ; (c) petit stromatolithe dont les couches gélatineuses ont été écrasées par le poids de la silice hydrothermale précipitée au-dessus ; (d) stromatolithe en forme d’onde basse (cf. [40])..
.
6. Discussion et conclusions
À l’échelle de l’histoire de la vie, les données rapportées ici concernent une vie relativement simple et représentée par des microorganismes unicellulaires, les procaryotes. En même temps, cette vie était déjà bien diversifiée, dans les limites d’un métabolisme anaérobie (à la Gould [9]), et avait également développé la photosynthèse anaérobie. En tant qu’organismes haploïdes qui se reproduisent par scissiparité (ou fissiparité), l’évolution de ces procaryotes primitifs, par le transfert horizontal des gènes, devait être extrêmement importante. C’est à cause de ce processus qu’ils ont pu coloniser et s’adapter à tous les habitats disponibles à l’époque.
À la date d’aujourd’hui, nous ne disposons d’aucune roche contenant l’histoire des premiers pas de la vie jusqu’à l’apparition de LUCA (Last Universal Common Ancestor). Les résultats décrits ici concernent les premiers témoignages de la vie fossile. Ils démontrent que, si la vie terrestre n’est apparue qu’après le dernier impact délétère (entre 4,0 et 3,85 Ga), elle a dû se répandre et se diversifier rapidement. Pourtant, à partir de cette vie anaérobie, vieille de presque 3,5 Ga, il a fallu attendre plus de 500 Ma pour voir apparaître l’étape suivante – l’évolution de la photosynthèse oxygénique. La butée droite de la première méga-trajectoire dans l’échelle de Knoll et Bambach [19] conduisant à LUCA avait été franchie, la vie se trouvait dans la deuxième méga-trajectoire, c’est-à-dire, la diversification de la vie procaryote, seulement 350 à 500 Ma après l’apparition de la vie. Alors, pourquoi a-t-il fallu une pause ou stase d’encore 500 Ma pour voir apparaître la photosynthèse oxygénique ? La réponse est probablement liée à l’évolution géologique de la Terre et à la formation des continents, avec des plates-formes continentales larges et ensoleillées ; c’est-à-dire, la création d’environnements nouveaux pouvant être conquis par des organismes bénéficiant de mutations particulièrement efficaces, à savoir les procaryotes utilisant la photosynthèse anaérobie. Pourtant, bien qu’il y ait eu une évolution et une diversification continue de la vie avec l’apparition de l’oxygène dans l’atmosphère et des eucaryotes, les procaryotes demeurèrent la base de la chaîne alimentaire et représentent toujours la fraction la plus importante de la biomasse terrestre.
Comme on l’a déjà évoqué, la relation intime entre la vie et la planète sert de base à l’hypothèse de Gaia [23, 28 and 53]. La production d’oxygène via la photosynthèse oxygénique illustre parfaitement l’importance des rapports entre la vie, la planète et l’évolution. Mais y a-t-il une relation entre la vie procaryote, représentée par les microfossiles de l’Archéen inférieur et leur environnement décrits ci-dessus et leur environnement ? Au-delà de l’existence des habitats exploitables et exploités, la présence d’organismes vivants a influencé l’environnement lui-même. En premier lieu, les mattes microbiennes à la surface des sédiments, avec leur énorme quantité de polymères collants et enveloppants, ont stabilisé la surface des sédiments. Ce processus est bien connu dans des environnements sous-marins et littoraux modernes [45]. La croissance rapide des mattes microbiennes peut même aller jusqu’à stabiliser des rides de sables entre deux marées (L. Stahl, commun. pers. comm., 2001) ! En ce qui concerne les mattes microbiennes de l’Archéen inférieur, leur présence à la surface des sédiments volcanoclastiques a sûrement contribué à stabiliser ces sédiments, surtout les mattes robustes formées dans l’environnement subaérien littoral où elles formèrent une sorte de tapis collant sur les clastes volcaniques.
Dès l’apparition de la photosynthèse oxygénique et des cyanobactéries, la vie a fortement influencé la formation des sédiments, surtout des calcaires, avec la précipitation de bio-minéraux, comme, par exemple le carbonate de calcium et les phosphates, pour former des stromatolithes, très fréquents dans l’Archéen supérieur et le Protérozoïque. De plus, les grands dépôts de fer rubanés sont dus à l’oxygène, gaz produit par les cyanobactéries et présent dans l’atmosphère et dissous dans l’eau de mer. Même avant l’apparition des cyanobactéries, les procaryotes de l’Archéen inférieur ont influencé la précipitation des minéraux au voisinage des mattes microbiennes et leur propre fossilisation. Toutefois, cette influence est restée mineure par rapport à celle des cyanobactéries de l’époque suivante, car la biomasse de l’Archéen inférieur était faible, comme déjà mentionné. Dans les limites de notre étude, il semble que des minéraux, comme, par exemple, la calcite, l’aragonite et les halogénures, aient précipité à l’intérieur et sur les biofilms ; de plus, les biofilms ont été perminéralisés ou remplacés par la silice. Comme je l’ai expliqué dans mes articles [47 and 50], la surface des procaryotes et leurs polymères fonctionnent comme des capteurs chimiques pour les minéraux dissous dans l’eau, ce qui permet une fossilisation rapide dans des conditions idéales. De cette manière, la matière organique chélate les minéraux qui se retrouvent concentrés dans les réseaux organiques.
Les eaux de l’Archéen inférieur étaient riches en silice dissoute d’origine hydrothermale [18]. La silice a donc formé la matrice des sédiments volcaniclastiques et a souvent remplacé les phases minérales dans les sédiments. La présence de matière organique, soit sous forme organisée comme dans les organismes ou les biofilms, soit sous forme amorphe comme dans les polymères libres (particulate organic matter), a eu une influence importante sur la précipitation de la silice et sur sa polymérisation pendant la diagenèse précoce. En effet, les cristaux de silice, formés en association avec la matière organique dans la matrice, sont très petits, comparés aux cristaux dans la matrice formés en absence de matière organique. Il semble que la présence de matière organique empêche la croissance des cristaux de silice, probablement à cause de la chélation de molécules organiques sur les surfaces des minéraux en croissance.
En conclusion, les premiers vestiges des systèmes vivants démontrent que la vie interagissait déjà avec son environnement ; elle exploitait les niches disponibles et, en contre-partie, elle altérait son environnement (i) physiquement en stabilisant les sédiments par les mattes microbiennes et (ii) chimiquement en servant de support pour la chélation de minéraux.
Gould [9], en parlant de la richesse de la vie bactérienne, considérait que nous vivons dans « l’âge des bactéries » : la vie sur Terre a toujours été, et sera toujours, caractérisée par les bactéries. La suprématie de ces formes de vie, relativement simples, peut être mesurée par leur durée (elles représentent les plus vieux organismes et seront les dernières à s’éteindre), leur résistance remarquable (elles supportent bien les conditions extrêmes), leur ubiquité (on les trouve partout et seules les laves incandescentes en sont dépourvues), leur taxonomie (chacune des divisions des Bactéries et Archaea est plus grande « que les trois règnes multicellulaires (plantes, champignons et animaux) réunis »), et leur utilité puisque ce sont elles qui génèrent une partie de l’oxygène dans l’atmosphère aujourd’hui, et qui, en symbiose, contribuent aux autres formes de vie, y compris la nôtre.
Remerciements
Je remercie vivement mes collègues A. Brack et B. Barbier pour le soin qu’ils ont apporté à la lecture de ce texte et à l’amélioration du français. Les commentaires très appréciés de F. Martin, E. Verrecchia et D. Néraudeau ont permis d’améliorer le contenu du manuscrit.
Bibliographie
1. P.W.U. Appel and S. Moorbath, Exploring Earth’s oldest geological record. Eos 80 (1999), pp. 257-264.
2. V.R. Baker, Water and the Martian landscape. Nature 412 (2001), pp. 228-236.
3. G.R. Byerly, M.M. Walsh and D.L. Lowe, Stromatolites from the 3300-3500 Myr Swaziland Supergroup, Barberton Mountain Land, South Africa. Nature 319 (1986), pp. 489-491.
4. I.H. Campbell and I.R. Taylor, No water, no granites – no oceans, no continents. Geophys. Res. Lett. 10 (1983), pp. 1061-1064.
5. S.M. Clifford and T.J. Parker, The evolution of the Martian hydrosphere : implications for the fate of a primordial ocean and the current state of the Northern Plains. Icarus 154 (2001), pp. 40-79.
6. A.W. Decho, Microbial exopolymer secretions in ocean environments : their role(s) in food webs and marine processes. Oceanogr. Mar. Biol. Annu Rev. 28 (1990), pp. 73-153.
7. N. Eldredge and S.J. Gould, Punctuated equilibria : an alternative to phylogenetic gradualism. In : T.J.M. Schopf, Editor, Models in Paleobiology, Freeman, Cooper and Co, San Francisco (1972), pp. 82-115.
8. C.M. Fedo and M.J. Whitehouse, Metasomatic origin of quartz-pyroxene rock, Akilia, Greenland, and implications for Earth’s earliest life. Science 295 (2002), pp. 1448-1452.
9. S.J. Gould, L’éventail du vivant. , Seuil, Paris (1997).
10. T.-M. Han and B. Runnegar, Megascopic eukaryotic algae from the 2.1-billion-year-old Negaunee Iron-Formation, Michigan. Science 257 (1992), pp. 232-235. Abstract-EMBASE | Abstract-MEDLINE
11. W.K. Hartmann, G. Ryder, L. Dones and D. Grinspoon, The time-dependent intense bombardment of the primordial Earth/Moon system. In : R.M. Canup and K. Righter, Editors, Origin of The Earth and Moon, University of Arizona Press (2000), pp. 493-512.
12. H.J. Hofmann, K. Grey, A.H. Hickman and R.I. Thorpe, Origin of 3.45 Ga coniform stromatolites in Warrawoona Group, Western Australia. Geol. Soc. Am. Bull. 111 (1999), pp. 1256-1262.
13. G.E. Hutchinson, The ecological theater and the evolutionary play. , Yale University Press, Newhaven, CT (1965).
14. B.M. Jakosky and R.J. Philips, Mars’ volatile and climate history. Nature 412 (2001), pp. 237-244.
15. J.F. Kasting, CO2 Condensation and the climate of early Mars. Icarus 94 (1991), pp. 1-13.
16. J. Kazmierczak and W. Altermann, Neoarchean biomineralisation by benthic cyanobacteria. Science 298 (2002), pp. 2351-2352.
17. J.L. Kirschvink, E.J. Gaidos, L.E. Batani, N.J. Beukes, J. Gutzmer, L.N. Maepa and R.E. Steinberger, Paleoproterozoic snowball Earth : extreme climatic and geochemical global change and its biological consequences. Proc. Natl Acad. Sci. USA 97 4 (2000), pp. 1400-1405.
18. L.P. Knauth and D.R. Lowe, High Archean climatic temperature inferred from oxygen isotope geochemistry of cherts in the 3.5 Ga Swaziland Supergroup, South Africa. Bull. Geol. Soc. Am. 115 (2003), pp. 566-580.
19. A.H. Knoll and R.K. Bambach, Directionality in the history of life : diffusion from the left wall or repeated scaling of the right ?. Paleobiology 26 suppl (2000), pp. 1-14.
20. A. Lepland, G. Arrhenius and D. Cornel, Apatite in Early Archean Isua supracrustal rocks, southern West Greenland : its : origin, association with graphite and potential as a biomarker. Precambrian Res. 118 (2002), pp. 221-241.
21. B.R. Levin and C.T. Bergstrom, Bacteria are different : observations, interpretations, speculations, and opinions about the mechanisms of adaptive evolution in prokaryotes. Proc. Natl Acad. Sci. USA 97 (2000), pp. 6981-6985. 22. J.F. Lindsay and M.D. Brasier, A carbon isotope reference curve for c.1700 to 1575 Ma, McArthur and Mount Isa Basins, northern Australia. Precambrian Res. 99 (2000), pp. 271-308.
23. J. Lovelock, Gaia. , Oxford University Press, Oxford, UK (1979).
24. D.R. Lowe, Abiological origin of described stromatolites older than 3.2 Ga. Geology 22 (1994), pp. 287-390.
25. M.T. Madigan, J.M. Martinko and J. Park, Brock : Microbiology of microorganisms. , Prentice, Upper Saddle River, New Jersey (1999).
26. K.A. Maher and D.J. Stephenson, Impact frustration of the origin of life. Nature 331 (1988), pp. 612-614. 27. L. Margulis and D. Sagan, Microcosmos. , Allen & Unwin, London (1987, 301 p).
28. L. Margulis and D. Sagan, What is life ?. , Simon & Schuster, New York (1995).
29. J. Maynard Smith and E. Szathmàry, The major transitions in evolution. , W.H. Freeman Spektrum, Oxford, UK (1995).
30. S.J. Mojzsis, G. Arrhenius, K.D. Keegan, T.H. Harrison, A.P. Nutman and C.L.R. Friend, Evidence for life on Earth before 3,800 million years ago. Nature 384 (1996), pp. 55-59.
31. S.J. Mojzsis, T.M. Harrison and R.T. Pidgeon, Oxygen-isotope evidence from ancient ircons for liquid water at the Earth’s surface 4300 Myr ago. Nature 409 (2001), pp. 178-181.
32. J. Myers, Isua enigmas : illusive tectonic, sedimentary, volcanic, and organic features of the >3.8->3.7 Ga isua greenstone belt, south-west Greenlanf. Geophys. Res. Abstr. 5 (2003), p. 13823.
33. H.D. Pflug, Archean fossil finds resembling yeasts. Geol. Palaeontol. 13 (1979), pp. 1-8.
34. H.D. Pflug and H. Jaeschke-Boyer, Combined structural and chemical analysis of 3800-Myr-old microfossils. Nature 280 (1979), pp. 483-486.
35. A. de Ricqlès, L’évolution selon Stephen J. Gould. La Recherche 356 (2002), pp. 25-32.
36. E.I. Robbins, Appelella ferrifera, a possible new iron-coated microfossil in the Isua Iron-Formation, Southwestern Greenland. In : P.W.U. Appel and G.L. LaBerge, Editors, Precambrian Iron Formations, Theophrastes, Athens (1987), pp. 141-154.
37. M. Rosing, 13C depleted carbon microparticles in >3700-Ma sea-floor sedimentary rocks from West Greenland. Science 283 (1999), pp. 674-676.
38. G. Ryder, Bombardment of the Hadean earth : wholesome or deleterious ?. Astrobiology 3 (2003), pp. 3-6. A
39. G. Ryder, C. Koeberl and S.J. Mojzsis, Heavy bombardment on the Earth at 3.85 Ga : The search for petrographic and geochemical evidence. In : R.M. Canup and K. Righter, Editors, Origin of The Earth and Moon, University of Arizona Press, Arizona (2000), pp. 475-492.
40. M. Schidlowski, J.M. Hayes and I.R. Kaplan, Isotopic inferences of ancient biochemistries : carbon, sulfur, hydrogen and nitrogen. In : J.W. Schopf, Editor, Earth’s earliest biosphere : its origin and evolution, Princeton University Press, Princeton (1983), pp. 149-186.
41. N.H. Sleep, K.J. Zahnle, J.F. Kasting and H.J. Morowitz, Annihilation of ecosystems by large asteroid impacts on the early Earth. Nature 342 (1989), pp. 139-142.
42. D.J. Stephenson, Mars’ core and magnetism. Nature 412 (2001), pp. 214-219.
43. R.E. Summons, L.L. Jahnke, J.M. Hope and J.H. Logan, 2-Methylhopanoids as biomarkers for cyanobacterial oxygenic photosynthesis. Nature 400 (1999), pp. 554-557.
44. M. Van Zuilen, A. Lepland and G. Arrhenius, Reassessing the evidence for the earliest traces of life. Nature 418 (2002), pp. 627-630. 45. V. Wachendörfer, W.E. Krumbein and H.J. Schellnhuber, Bacteriogenic porosity of marine sediments – a case for biomorphogenesis of sedimentary rocks. In : W.E. Krumbein, D.M. Paterson and L.J. Stahl, Editors, Biostabilisation of sediments, BIS, Oldenburg, Germany (1994), pp. 203-220.
46. M.M. Walsh, Microfossils and possible microfossils from the Early Archean Onverwacht Group, Barberton Mountain Land, South Africa. Precambrian Res. 54 (1992), pp. 271-293.
47. F. Westall, The nature of fossil bacteria. J. Geophys. Res. Planets 104 (1999), pp. 16 437-16 451.
48. F. Westall, Le contexte géologique pour l’origine de la vie et les signatures minérales de la vie fossile, in : M.M. Gargaud, et al. (Eds.), Les traces du vivant, Presses universitaires de Bordeaux (sous presse)
49. F. Westall and R.L. Folk, Endogenous and exogenous carbonaceous microstructures in Early Archaean cherts and BIFs from the Isua greenstone belt : implications for the search for life in ancient rocks. Precambrian Res. (2003), pp. 313-330.
50. F. Westall, A. Steele, J. Toporski, M. Walsh, C. Allen, S. Guidry, E. Gibson, D. Mckay and H. Chafetz, Polymeric substances and biofilms as biomarkers in terrestrial materials : Implications for extraterrestrial samples. J. Geophys. Res. Planets 105 (2000), pp. 24 511-24 527.
51. F. Westall, M.J. De Wit, J. Dann, S. Van Der Gaast, C. De Ronde and D. Gerneke, Early Archaean fossil bacteria and biofilms in hydrothermally-influenced, shallow water sediments, Barberton greenstone belt, South Africa. Precambrian Res. 106 (2001), pp. 93-116.
52. F. Westall, A. Brack, B. Barbier, M. Bertrand and A. Chabin, Early earth and early life : an extreme environment and extremophiles – application to the search for life on Mars. In : (2002), pp. 131-136. Abstract-Compendex
53. P. Westbroek, Life as a geological force. Dynamics of the Earth. , W.W. Norton, New York (1991).
54. S.A. Wilde, J.W. Valley, W.H. Peck and C.M. Graham, Evidence from detrital zircons for the existence of continental crust and oceans on earth 4.4 Gyr ago. Nature 409 (2001), pp. 175-178.








Aucun commentaire sur l'article Stephen Jay Gould, les procaryotes et leur évolution dans le contexte géologique