Par Suzanne Sommer
.
1- Une capacité exceptionnelle à tolérer les lésions de l’ADN
.
La bactérie Deinococcus radiodurans est surtout connue pour sa capacité exceptionnelle à surmonter l’effet létal et mutagène des agents qui endommagent l’ADN, en particulier les effets des radiations ionisantes, de la dessication et du rayonnement ultraviolet (Mattimore and Battista, 1996 ; Sweet and Moseley, 1974, 1976). Ces agents provoquent des dommages variés de l’ADN (oxydation de bases, cassures simple et double brins, dimères de pyrimidines) (Battista et al., 1999 ; Mattimore and Battista, 1996 ; Sweet and Moseley, 1974, 1976 ; Ward, 1975, 1988). La résistance de la bactérie D. radiodurans aux agents qui endommagent l’ADN n’est pas due à des mécanismes de protection de l’ADN qui empêcheraient la formation des lésions (Gerard et al., 2001) mais à une réparation particulièrement performante de ces lésions.
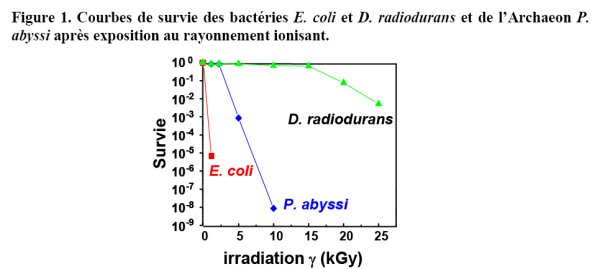
La viabilité de la bactérie D. radiodurans n’est pas affectée si elle est soumise à une irradiation γ provoquant environ 200 cassures double-brins, 3000 cassures simple-brins et plus de 1000 bases endommagées par équivalent génome (survie de 100 % pour une exposition à une dose de 6000 Gy de rayonnement γ) et sa survie reste très significative à des doses supérieures à 10000 Gy (Figure 1). A titre de comparaison, des doses 250 fois inférieures suffisent pour stériliser la majorité des cultures bactériennes (exemple : Escherichia coli) (Figure 1). La bactérie D. radiodurans est également très résistante à la dessication (Mattimore and Battista, 1996). En effet, on trouve encore plus de 80% de cellules viables dans des cultures séchées sur une lame de verre et gardées 2 ans dans un dessicateur.
.
.
Les doses d’irradiation n’excédant pas 200 mGy par an dans les environnements naturels (Battista et al., 1999), il est peu probable que cette espèce ait acquis des mécanismes spécifiques pour résister à de fortes doses d’irradiation et sa radiotolérance résulte probablement d’expositions à des cycles répétés de dessication-réhydratation qui ont conduit à la sélection de mécanismes de réparation de l’ADN particulièrement performants. On peut également noter une résistance exceptionnelle à une exposition prolongée au rayonnement ultraviolet capable d’engendrer plusieurs milliers de dimères de pyrimidines dans son génome (5000 dimères de pyrimidines engendrés par une exposition à une dose de rayonnement UV de 500 J / m2).
Parmi les lésions provoquées par les radiations ionisantes, les cassures double brins sont considérées comme les plus redoutables sur le plan génotoxique (Ward, 1988). Une absence de réparation des cassures de l’ADN aboutit à la mort cellulaire alors qu’une réparation infidèle de ces lésions va conduire à des mutations et des remaniements chromosomiques qui sont à la base du développement de tumeurs ou de maladies héréditaires chez l’homme (Little, 2000). La bactérie D. radiodurans qui est l’organisme le plus radiotolérant identifié à ce jour constitue un modèle particulièrement bien choisi pour élucider les mécanismes de réparation des cassures de l’ADN. Une analyse génétique des mécanismes intervenant dans la réparation des cassures de l’ADN est facilitée par la transformabilité naturelle de cette bactérie. De plus la séquence complète annotée de son génome a été publiée (White et al., 1999).
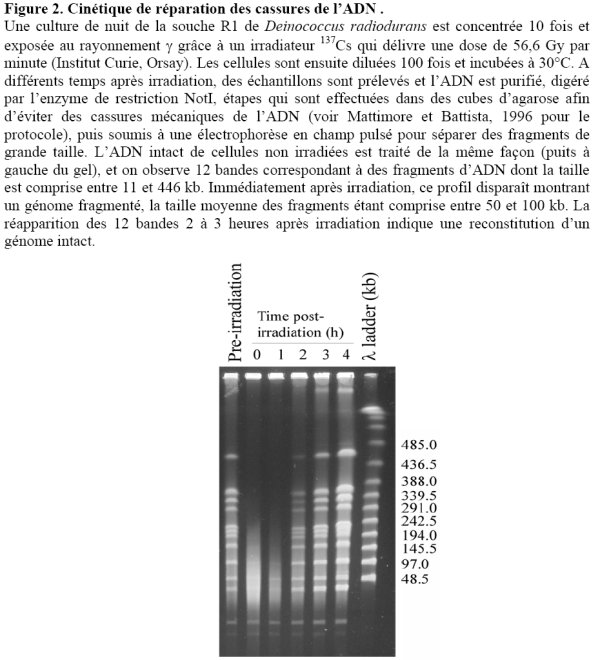
Deinococcus radiodurans est capable de reconstituer un génome intact à partir d’une myriade de fragments engendrés par l’exposition des bactéries à des doses massives de radiations ionisantes ou par des cycles répétés de dessiccation/réhydratation (Figure 2).
Les doses d’irradiation n’excédant pas 200 mGy par an dans les environnements naturels (Battista et al., 1999), il est peu probable que cette espèce ait acquis des mécanismes spécifiques pour résister à de fortes doses d’irradiation et sa radiotolérance résulte probablement d’expositions à des cycles répétés de dessication-réhydratation qui ont conduit à la sélection de mécanismes de réparation de l’ADN particulièrement performants. On peut également noter une résistance exceptionnelle à une exposition prolongée au rayonnement ultraviolet capable d’engendrer plusieurs milliers de dimères de pyrimidines dans son génome (5000 dimères de pyrimidines engendrés par une exposition à une dose de rayonnement UV de 500 J / m2).
Parmi les lésions provoquées par les radiations ionisantes, les cassures double brins sont considérées comme les plus redoutables sur le plan génotoxique (Ward, 1988). Une absence de réparation des cassures de l’ADN aboutit à la mort cellulaire alors qu’une réparation infidèle de ces lésions va conduire à des mutations et des remaniements chromosomiques qui sont à la base du développement de tumeurs ou de maladies héréditaires chez l’homme (Little, 2000). La bactérie D. radiodurans qui est l’organisme le plus radiotolérant identifié à ce jour constitue un modèle particulièrement bien choisi pour élucider les mécanismes de réparation des cassures de l’ADN. Une analyse génétique des mécanismes intervenant dans la réparation des cassures de l’ADN est facilitée par la transformabilité naturelle de cette bactérie. De plus la séquence complète annotée de son génome a été publiée (White et al., 1999).
Deinococcus radiodurans est capable de reconstituer un génome intact à partir d’une myriade de fragments engendrés par l’exposition des bactéries à des doses massives de radiations ionisantes ou par des cycles répétés de dessiccation/réhydratation (Figure 2).
.
2- Mécanismes de réparation des cassures de l’ADN
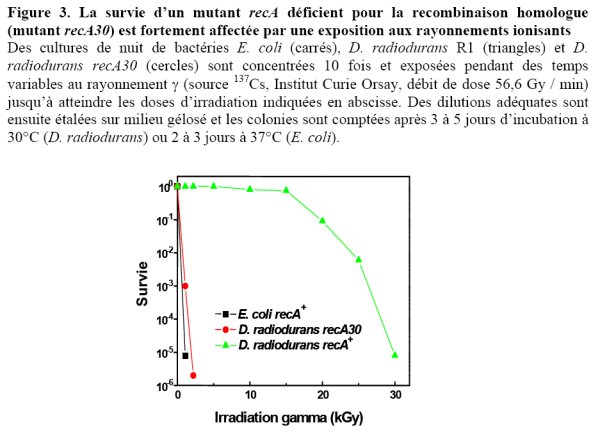
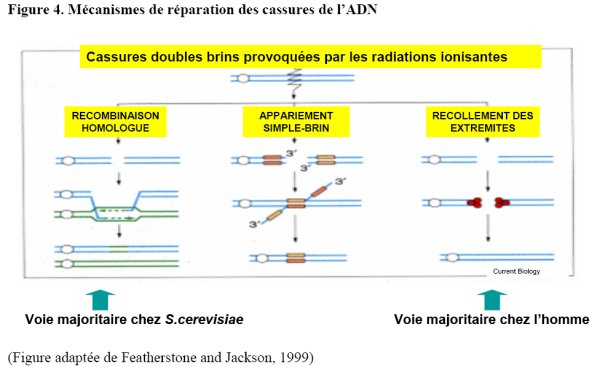
Les bases moléculaires de la radiorésistance de D. radiodurans sont encore peu comprises. La reconstitution d’un génome intact à partir de centaines de fragments fait appel à des mécanismes de recombinaison homologue impliquant la protéine RecA (figure 3) (Daly et al., 1994 ; Daly and Minton, 1995 ; Moseley and Copland, 1975), mais également à d’autres mécanismes indépendants de la protéine RecA agissant en conjonction avec la recombinaison homologue pour une réparation efficace des cassures (figure 4) (Daly and Minton, 1996). Des études biochimiques récentes ont mis en évidence des propriétés originales de la protéine RecA (Kim and Cox, 2002 ; Kim et al., 2002), en particulier sa capacité d’initier la recombinaison par fixation sur un substrat d’ADN double-brin, alors que toutes les expériences de recombinaison in vitro faites jusque là en utilisant des protéines RecA bactériennes ou leurs homologues Rad51 eucaryotes montraient que la formation d’un filament RecA (Rad51) sur un ADN simple-brin était un prérequis pour initier la recombinaison (Kim and Cox, 2002 ; Kim et al., 2002). Cette propriété particulière de la protéine RecA de D. radiodurans pourrait faciliter la réparation des cassures double-brin en ne rendant pas l’initiation de la recombinaison dépendante de la formation d’ADN simplebrin au niveau des extrémités.
.
3- L’apport de la génomique dans l’élucidation des mécanismes de radiotolérance
.
L’analyse de la séquence du génome de D. radiodurans montre l’existence de gènes impliqués dans les systèmes classiques de réparation des lésions de l’ADN (Makarova et al., 2001 ; White et al., 1999). On retrouve deux systèmes permettant d’éliminer les lésions UV, l’un faisant appel à une endonucléase spécifique coupant spécifiquement en 5’ des dimères de pyrimidines (Earl et al., 2002 ; Tanaka et al., 2005) et l’autre, à plus large spectre, capable d’éliminer les lésions encombrantes par excision d’un petit fragment simple-brin d’ADN qui porte la lésion (13 à 14 nucléotides) et resynthèse d’un ADN intact en prenant pour matrice le brin complémentaire (nucleotide excision repair = NER) (Agostini et al., 1996 ; Evans and Moseley, 1983 ; Narumi et al., 1997). De même, on retrouve la batterie classique de glycosylases capables d’éliminer de façon spécifique toute une série de bases modifiées (base excision repair = BER) (Sandigursky et al., 2004) ainsi que les gènes codant les protéines capables de reconnaître et de réparer les mésappariements de l’ADN assurant ainsi la fidélité de la réplication (mismatch repair = MMR) (Mennecier et al., 2004). Le gène recA codant la recombinase RecA ainsi que les gènes classiques codant les protéines responsables de la migration et de la résolution des jonctions de Hollyday sont présents. La question de l’initiation de la recombinaison et des mécanismes qui assurent la maturation des extrémités reste ouverte. On ne retrouve pas dans le génome de D. radiodurans de gènes homologues aux gènes recB et recC qui codent les activités nucléases et hélicases responsables de la formation à partir des cassures double-brins d’extrémités simple-brin nécessaires pour l’initiation de la recombinaison chez la bactérie E. coli. On retrouve par contre dans le génome de D. radiodurans les homologues des gènes Rad50 et Mre11 qui sont essentiels chez les eucaryotes pour l’initiation de la réparation des cassures de l’ADN par recombinaison homologue ou par recollement des extrémités. On retrouve également les homologues des gènes nurA et herA (Iyer et al., 2004), qui codent respectivement des protéines présentant des activités nucléases et hélicases chez les Archaea (Constantinesco et al., 2002 ; Constantinesco et al., 2004) et qui ont été proposés pour agir en conjonction avec les produits des gènes rad50 et mre11 dans la réparation des cassures de l’ADN (Constantinesco et al., 2002 ; Constantinesco et al., 2004).
L’analyse du génome a également permis de mettre en évidence la présence d’un gène codant pour une polymérase de la famille X, polymérases présentes chez les eucaryotes (Pol β, pol λ) mais très rares chez les procaryotes (Lecointe et al., 2004).
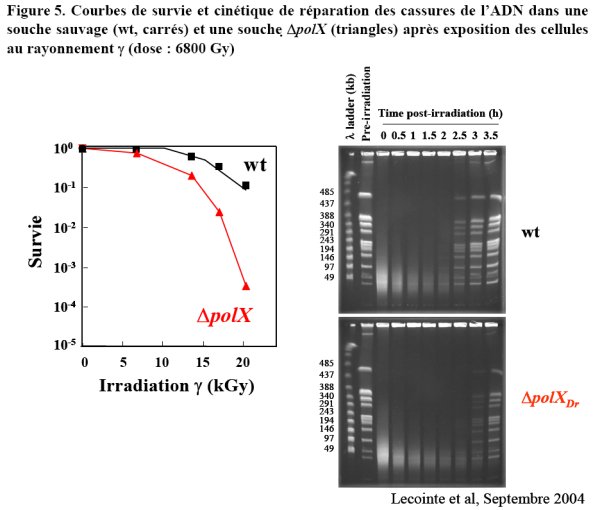
D. radiodurans étant une bactérie qui se manipule très bien génétiquement, de nombreuses études ont permis d’inactiver tous ces gènes et d’évaluer leur rôle potentiel dans la radiorésistance. Seule, l’inactivation du gène recA aboutit à un phénotype drastique de sensibilisation aux agents qui endommagent l’ADN (figure 3). L’inactivation des autres gènes engendre des phénotypes plus subtils, suggérant, soit une redondance de certaines fonctions, soit une pluralité de mécanismes qui, ensemble concourent à conférer une résistance exceptionnelle aux agents génotoxiques. On peut donner l’exemple de l’inactivation du gène polX qui se traduit par une sensibilisation uniquement pour des doses élevées d’irradiation γ et par un retard dans la cinétique de réparation des cassures pour des doses qui permettent une survie voisine de 100% aux bactéries irradiées (figure 5) (Lecointe et al., 2004).
.
L’analyse globale de l’expression des gènes après irradiation ou dessication (analyse transcriptomique) s’est révélée très fructueuse pour identifier de nouveaux gènes impliqués dans la radiotolérance de la bactérie D. radiodurans (Tanaka et al., 2004). Elle a permis de mettre en évidence des gènes n’ayant pas d’équivalent dans les autres génomes séquencés (gènes orphelins) et qui sont fortement induits après exposition aux rayonnements ionisants ou dessication prolongée. Alors que 72 gènes sont induits par irradiation et 73 gènes par dessication / réhydratation, 33 sont communs aux deux réponses (Tanaka et al., 2004). On retrouve parmi ces 33 gènes, le gène recA, des gènes impliqués dans la réparation par excision de nucléotides, dans l’adaptation au stress oxydatif ou au choc thermique, dans la restoration du surenroulement de l’ADN mais la majorité des gènes induits sont orphelins. Les 5 gènes les plus induits sont communs aux deux réponses et codent des protéines de fonction inconnue. L’inactivation de ces gènes montre l’importance de certains dans la tolérance de D. radiodurans aux radiations. La purification des produits de deux de ces gènes, DdrA et PprA, et leur caractérisation biochimique a permis de montrer que (1) la protéine DdrA se fixe aux extrémités de l’ADN simple-brin et empêche la dégradation de celui-ci par des exonucléases (Harris et al., 2004) (2) la protéine PprA se fixe sur un ADN double brin qui porte des cassures simple ou double brin, protège les extrémités de la dégradation par des nucléases et facilite la ligation de fragments d’ADN en stimulant l’activité d’ADN-ligases (Narumi et al., 2004).
L’inactivation des gènes ddrA et pprA a permis de montrer que ces protéines jouent un rôle crucial dans la radiorésistance suggérant l’existence de mécanismes originaux de réparation des cassures de l’ADN chez cette bactérie.
.
4- Structuration du génome de D. radiodurans
.
Des analyses par microscopie électronique ont montré que le nucléoide de D. radiodurans est organisé sous forme d’un toroide fortement structuré, structure maintenue après exposition à de fortes doses d’irradiation. Cette structuration particulière du génome pourrait jouer un rôle clé dans la réparation, en évitant la dispersion des fragments dans la cellule, en maintenant la proximité des extrémités et la continuité linéaire du génome fragmenté. Cette structure pourrait favoriser un mécanisme de réparation de l’ADN par recollement des extrémités (Levin-Zaidman et al., 2003). Une étude plus large portant sur la comparaison de la structure du nucléoide de 7 espèces différentes de Deinococcacae, de la bactérie radiorésistante Rubrobacter radiotolerans et de la bactérie Thermus aquaticus phylogénétiquement proche des Deinococcacea mais radiosensible a permis de montrer que la structure torroidale du nucléoide de D. radiodurans n’était conservée que chez D. murrayi, D. proteolyticus, D. radiophilus, D. grandis (Zimmerman and Battista, 2005). L’ADN de R. radiotolerans se présente sous forme de plusieurs sphères fortement condensées dans la cellule alors que les génomes de D. radiopugnans et D. geothermalis ne présentent pas d’organisation particulière (Zimmerman and Battista, 2005). D. radiodurans contient 4 à 10 copies de son génome par cellule (Harsojo et al., 1981) ; il a été proposé que les différentes copies soient préalignées, favorisant la recherche d’homologie dans un mécanisme de réparation par recombinaison homologue et la fidélité de la réparation. Cependant l’existence d’un tel alignement n’a pas pu être démontrée.
.
Conclusion
.
La résistance exceptionnelle de D. radiodurans au rayonnement ionisant et à des cycles répétés de dessication-réhydratation semble être la conséquence de processus d’évolution qui augmentent l’efficacité des mécanismes connus de réparation de l’ADN. Chaque mécanisme contribue probablement de façon modeste mais, ensemble, ils sont capables de conférer à D. radiodurans cette exceptionnelle capacité à réparer les cassures de l’ADN.
.
Références
.
- Agostini, H.J., Carroll, J.D., and Minton, K.W. (1996) Identification and characterization of uvrA, a DNA repair gene of Deinococcus radiodurans. J Bacteriol 178 : 6759-6765.
- Anderson, A.W., Nordon, H.C., Cain, R.F., Parrish, G., and Duggan, G. (1956) Studies on a radio-resistant micrococcus. I. Isolation, morphology, cultural characteristics, and resistance to gamma radiation. Food Technol. 10 : 575-578.
- Battista, J.R., Earl, A.M., and Park, M.J. (1999) Why is Deinococcus radiodurans so resistant to ionizing radiation ? Trends Microbiol 7 : 362-365.
- Brooks, B.W., and Murray, R.G.E. (1981) Nomenclature for « Micrococcus radiodurans » and other radiation resistant cocci : Deinococcaceae fam. nov. and Deinococcus gen. nov., including five species. Int. J. Syst. Bacteriol. 31 : 353-360
- Constantinesco, F., Forterre, P., and Elie, C. (2002) NurA, a novel 5’-3’ nuclease gene linked to rad50 and mre11 homologs of thermophilic Archaea. EMBO Rep 3 : 537-542.
- Constantinesco, F., Forterre, P., Koonin, E.V., Aravind, L., and Elie, C. (2004) A bipolar DNA helicase gene, herA, clusters with rad50, mre11 and nurA genes in thermophilic archaea. Nucleic Acids Res 32 : 1439-1447.
- Daly, M.J., Ling, O., and Minton, K.W. (1994) Interplasmidic recombination following irradiation of the radioresistant bacterium Deinococcus radiodurans. J Bacteriol 176 : 7506-7515.
- Daly, M.J., and Minton, K.W. (1995) Interchromosomal recombination in the extremely radioresistant bacterium Deinococcus radiodurans. J Bacteriol 177 : 5495-5505.
- Daly, M.J., and Minton, K.W. (1996) An alternative pathway of recombination of chromosomal fragments precedes recA-dependent recombination in the radioresistant bacterium Deinococcus radiodurans. J Bacteriol 178 : 4461-4471.
- Earl, A.M., Rankin, S.K., Kim, K.P., Lamendola, O.N., and Battista, J.R. (2002) Genetic evidence that the uvsE gene product of Deinococcus radiodurans R1 is a UV damage endonuclease. J Bacteriol 184 : 1003-1009.
- Evans, D.M., and Moseley, B.E. (1983) Roles of the uvsC, uvsD, uvsE, and mtcA genes in the two pyrimidine dimer excision repair pathways of Deinococcus radiodurans. J Bacteriol 156 : 576-583.
- Featherstone, C., and Jackson, S.P. (1999) DNA double-strand break repair. Curr Biol 9 : R759-761.
- Ferreira, A.C., Nobre, M.F., Rainey, F.A., Silva, M.T., Wait, R., Burghardt, J., Chung, A.P., and da Costa, M.S. (1997) Deinococcus geothermalis sp. nov. and Deinococcus murrayi sp. nov., two extremely radiation-resistant and slightly thermophilic species from hot springs. Int J Syst Bacteriol 47 : 939-947.
- Gerard, E., Jolivet, E., Prieur, D., and Forterre, P. (2001) DNA protection mechanisms are not involved in the radioresistance of the hyperthermophilic archaea Pyrococcus abyssi and P. furiosus. Mol Genet Genomics 266 : 72-78.
- Harris, D.R., Tanaka, M., Saveliev, S.V., Jolivet, E., Earl, A.M., Cox, M.M., and Battista, J.R. (2004) Preserving genome integrity : the DdrA protein of Deinococcus radiodurans R1. PLoS Biol 2 : e304. Harsojo, Kitayama, S., and Matsuyama, A. (1981) Genome multiplicity and radiation resistance in Micrococcus radiodurans. J Biochem (Tokyo) 90 : 877-880.
- Hirsch, P., Gallikowski, C.A., Siebert, J., Peissl, K., Kroppenstedt, R., Schumann, P., Stackebrandt, E., and Anderson, R. (2004) Deinococcus frigens sp. nov., Deinococcus saxicola sp. nov., and Deinococcus marmoris sp. nov., low temperature and draughttolerating, UV-resistant bacteria from continental Antarctica. Syst Appl Microbiol 27 : 636-645.
- Iyer, L.M., Makarova, K.S., Koonin, E.V., and Aravind, L. (2004) Comparative genomics of the FtsK-HerA superfamily of pumping ATPases : implications for the origins of chromosome segregation, cell division and viral capsid packaging. Nucleic Acids Res 32 : 5260-5279.
- Kim, J.I., and Cox, M.M. (2002) The RecA proteins of Deinococcus radiodurans and Escherichia coli promote DNA strand exchange via inverse pathways. Proc Natl Acad Sci U S A 99 : 7917-7921.
- Kim, J.I., Sharma, A.K., Abbott, S.N., Wood, E.A., Dwyer, D.W., Jambura, A., Minton, K.W., Inman, R.B., Daly, M.J., and Cox, M.M. (2002) RecA Protein from the extremely radioresistant bacterium Deinococcus radiodurans : expression, purification, and characterization. J Bacteriol 184 : 1649-1660.
- Lecointe, F., Shevelev, I.V., Bailone, A., Sommer, S., and Hubscher, U. (2004) Involvement of an X family DNA polymerase in double-stranded break repair in the radioresistant organism Deinococcus radiodurans. Mol Microbiol 53 : 1721-1730.
- Levin-Zaidman, S., Englander, J., Shimoni, E., Sharma, A.K., Minton, K.W., and Minski, A. (2003) Ringlike structure of the Deinococcus radiodurans genome : a key to radioresistance ? Science 299 : 254-256.
- Little, J.B. (2000) Radiation carcinogenesis. Carcinogenesis 21 : 397-404.
- Makarova, K.S., Aravind, L., Wolf, Y.I., Tatusov, R.L., Minton, K.W., Koonin, E.V., and Daly, M.J. (2001) Genome of the extremely radiation-resistant bacterium Deinococcus radiodurans viewed from the perspective of comparative genomics. Microbiol Mol Biol Rev 65 : 44-79.
- Mattimore, V., and Battista, J.R. (1996) Radioresistance of Deinococcus radiodurans : functions necessary to survive ionizing radiation are also necessary to survive prolonged desiccation. J Bacteriol 178 : 633-637.
- Mennecier, S., Coste, G., Servant, P., Bailone, A., and Sommer, S. (2004) Mismatch repair ensures fidelity of replication and recombination in the radioresistant organism Deinococcus radiodurans. Mol Genet Genomics 272 : 460-469.
- Moseley, B.E., and Copland, H.J. (1975) Involvement of a recombination repair function in disciplined cell division of Micrococcus radiodurans. J Gen Microbiol 86 : 343-357.
- Narumi, I., Cherdchu, K., Kitayama, S., and Watanabe, H. (1997) The Deinococcus radiodurans uvr A gene : identification of mutation sites in two mitomycin-sensitive strains and the first discovery of insertion sequence element from deinobacteria. Gene 198 : 115-126.
- Narumi, I., Satoh, K., Cui, S., Funayama, T., Kitayama, S., and Watanabe, H. (2004) PprA : a novel protein from Deinococcus radiodurans that stimulates DNA ligation. Mol Microbiol 54 : 278-285.
- Rainey, F.A., Nobre, M.F., Schumann, P., Stackebrandt, E., and da Costa, M.S. (1997) Phylogenetic diversity of the deinococci as determined by 16S ribosomal DNA sequence comparison. Int J Syst Bacteriol 47 : 510-514.
- Sandigursky, M., Sandigursky, S., Sonati, P., Daly, M.J., and Franklin, W.A. (2004) Multiple uracil-DNA glycosylase activities in Deinococcus radiodurans. DNA Repair (Amst) 3 : 163-169. Suresh, K., Reddy, G.S., Sengupta, S., and Shivaji, S. (2004)
- Deinococcus indicus sp. nov., an arsenic-resistant bacterium from an aquifer in West Bengal, India. Int J Syst Evol Microbiol 54 : 457-461.
- Sweet, D.M., and Moseley, B.E. (1974) Accurate repair of ultraviolet-induced damage in Micrococcus radiodurans. Mutat Res 23 : 311-318.
- Sweet, D.M., and Moseley, B.E. (1976) The resistance of Micrococcus radiodurans to killing and mutation by agents which damage DNA. Mutat Res 34 : 175-186.
- Tanaka, M., Earl, A.M., Howell, H.A., Park, M.J., Eisen, J.A., Peterson, S.N., and Battista, J.R. (2004) Analysis of Deinococcus radiodurans’s transcriptional response to ionizing radiation and desiccation reveals novel proteins that contribute to extreme radioresistance. Genetics 168 : 21-33.
- Tanaka, M., Narumi, I., Funayama, T., Kikuchi, M., Watanabe, H., Matsunaga, T., Nikaido, O., and Yamamoto, K. (2005) Characterization of pathways dependent on the uvsE, uvrA1, or uvrA2 gene product for UV resistance in Deinococcus radiodurans. J Bacteriol 187 : 3693-3697.
- Ward, J.F. (1975) Radiation-induced strand breakage in DNA. Basic Life Sci 5B : 471-472.
- Ward, J.F. (1988) DNA damage produced by ionizing radiation in mammalian cells : identities, mechanisms of formation, and reparability. Prog Nucleic Acid Res Mol Biol 35 : 95-125.
- White, O., Eisen, J.A., Heidelberg, J.F., Hickey, E.K., Peterson, J.D., Dodson, R.J., Haft, D.H., Gwinn, M.L., Nelson, W.C., Richardson, D.L., Moffat, K.S., Qin, H., Jiang, L., Pamphile, W., Crosby, M., Shen, M., Vamathevan, J.J., Lam, P., McDonald, L., Utterback, T., Zalewski, C., Makarova, K.S., Aravind, L., Daly, M.J., Fraser, C.M., and et al. (1999) Genome sequence of the radioresistant bacterium Deinococcus radiodurans R1. Science 286 : 1571-1577.
- Zimmerman, J.M., and Battista, J.R. (2005) A ring-like nucleoid is not necessary for radioresistance in the Deinococcaceae. BMC Microbiol 5 : 17.
____________________________________
L’auteur, Suzanne Sommer, est professeur à l’Université Paris Sud. Elle dirige le Groupe Radiorésistance et mutagénèse chez les Deinococcaceae à l’Institut de Génétique et Microbiologie.
.





Bonjour,
J’ai essayé dans un travail précédent de prédire la fonction/ interactomes des protéines inconnues chez Deinococcus radiodurans.
Ce travail m’a descriminé 3 gènes probablement impliqués dans la radiorésistance.
Je souhaiterais bien vérifier leur role soit par clonage/ délétion ou bien RT-PCR.
Pourriez vous me donner des conseils.
Sincères salutations
Bonjour,
En réponse à votre commentaire je vous suggère de contacter directement l’auteur de cet article : suzanne.sommer(AT)igmors.u-psud.fr.
Cordialement
Bonjour.
Aucun raccourci n’existant pour relier les modalités de la vie sur terre à celles existant éventuellement sur un ou des corps planétaires du système solaire, les extrêmophiles terrestres ne représenteraient-ils pas une passerelle naturelle à partir de laquelle orienter la recherche ?